题目内容
7.比亚迪公司开发了锂钡氧化物二次电池.电池总反应为V2O4+xLi$?_{充电}^{放电}$LixV2O4,下列说法正确的是( )| A. | 该电池充电时,锂极与外电源的负极相连 | |
| B. | 该电池放电时,Li+向负极移动 | |
| C. | 该电池充电时阴极的反应为LixV2O4-xe-=V2O4+xLi+ | |
| D. | 若放电时转移 0.2 mol 电子,则消耗锂 1.4x g |
分析 放电时,该原电池中锂失电子而作负极,V2O5得电子而作正极,负极上发生氧化反应,正极上发生还原反应,阳离子向正极移动.
解答 解:A.该原电池中锂失电子而作负极,该电池充电时,锂极与外电源的负极相连,故A正确;
B.该原电池中,锂失电子而作负极,放电时Li+向正极移动,故B错误;
C.该电池充电时,正极与外接电源的正极相连为阳极,则阳极上LixV2O5失电子,阳极上电极反应式为:LixV2O5-xe-═V2O5+xLi+,故C错误;
D.1molLi转移1mol电子,则放电时转移 0.2 mol 电子,则消耗锂为0.2mol,即 1.4 g,故D错误;
故选A.
点评 本题考查原电池原理,明确元素化合价是解本题关键,根据得失电子来分析解答即可,难点是电极反应式的书写,题目难度中等.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
18.表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)实验4和5表明固体表面积对反应速率有影响;固体表面积越大,反应速率越快,能表明这一规律另一组实验是1和2(填实验序号).
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填序号).
(3)本实验中影响反应速率的其他因素还有温度,其实验序号是6和7.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:反应物用量相同,放出的热量相同.
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
(1)实验4和5表明固体表面积对反应速率有影响;固体表面积越大,反应速率越快,能表明这一规律另一组实验是1和2(填实验序号).
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填序号).
(3)本实验中影响反应速率的其他因素还有温度,其实验序号是6和7.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:反应物用量相同,放出的热量相同.
19.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
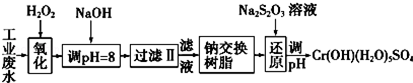
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
(1)氧化过程中可代替H2O2加入的试剂是A(填序号).
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.

 +CO2+H2O→
+CO2+H2O→ +NaHCO3.
+NaHCO3.
 .
.
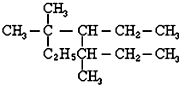 的名称是3,3,5-三甲基-4-乙基庚烷.
的名称是3,3,5-三甲基-4-乙基庚烷.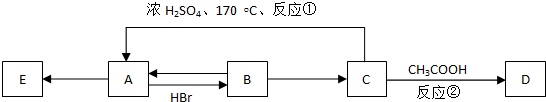
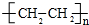 .
.