题目内容
8. 分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.
分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.请回答下列问题:
(1)Na2C2O4溶液与酸性KMnO4溶液反应的离子方程式是2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
(2)称取Wg Na2C2O4晶体配成100mL溶液,配制时使用的一种主要仪器是100mL容量瓶;
(3)移取20.00mLNa2C2O4溶液置于锥形瓶中,则酸性KMnO4溶液装在酸式滴定管中(填“酸”或“碱”)
(4)滴定终点的现象是滴入最后一滴KMnO4溶液,溶液由无色变为紫红色,且半分钟不褪色
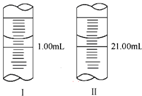
(5)若滴定管起始读数和终点读数如图所示,则酸性KMnO4溶液的物质的量浓度为$\frac{2W}{67}$mol•L-1
(6)下列操作导致测定的酸性KMnO4溶液浓度偏高的是d
a.配制Na2C2O4溶液定容时俯视
b.锥形瓶用蒸馏水洗净后,再用Na2C2O4溶液润洗2-3次
c.滴定前滴定管中有气泡,滴定终点滴定管中气泡消失
d.滴定前仰视读数,滴定终点俯视读数.
分析 (1)C2O42-具有还原性,把KMnO4还原为Mn2+,根据化合价升降方法,结合元素守恒、电荷守恒书写方程式;
(2)配制一定物质的量浓度的溶液需要容量瓶;
(3)酸性KMnO4溶液能氧化橡胶管;
(4)酸性KMnO4溶液为紫红色,滴定终点时无色变为紫红色;
(5)根据滴定管的结构、精确度以及测量原理来解答;根据关系式KMnO4~5Na2C2O4来计算;
(6)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(待测)的影响,以此判断浓度的误差.
解答 解:(1)C2O42-具有还原性,把KMnO4还原为Mn2+,自身被氧化为CO2,其反应的方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
故答案为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
(2)称取Wg Na2C2O4晶体配成100mL溶液,配制时使用的一种主要仪器是100mL容量瓶;
故答案为:100mL容量瓶;
(3)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应装在酸式滴定管中;
故答案为:酸;
(4)KMnO4溶液呈紫红色,草酸反应完毕,滴入最后一滴KMnO4溶液,溶液由无色变为紫红色,且半分钟不褪色为滴定到终点,
故答案为:滴入最后一滴KMnO4溶液,溶液由无色变为紫红色,且半分钟不褪色;
(5)滴定管的起始读数为0.70mL,终点读数为20.70mL,消耗酸性KMnO4溶液的体积为20.70mL-0.70mL=20.00mL;
KMnO4溶液的物质的量浓度为c,WgNa2C2O4配成100mL标准溶液,20.00mL溶液中含有Na2C2O4的质量为$\frac{W}{5}$g;
2KMnO4 ~5Na2C2O4
2moL 5×134g
0.02L×c $\frac{W}{5}$g
解得:c=$\frac{2W}{67}$mol•L-1
故答案为:$\frac{2W}{67}$mol•L-1;
(6)a.配制Na2C2O4溶液定容时俯视,溶液的体积偏小,导致浓度偏大,造成V(待测)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,则滴定结果偏小,故a错误;
b.锥形瓶用蒸馏水洗净后,再用Na2C2O4溶液润洗2-3次,待测液的物质的量偏大,造成V(待测)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,则滴定结果偏小,故b错误;
c.滴定前滴定管中有气泡,滴定终点滴定管中气泡消失,造成V(待测)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,则滴定结果偏小,故c错误;
d.滴定前仰视读数,滴定终点俯视读数,造成V(待测)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,则滴定结果偏大,故d正确;
故选d.
点评 本题以滴定原理考查物质含量的测定,把握滴定实验及仪器、滴定反应及误差分析为解答的关键,注意反向滴定的误差分析,题目难度不大.

| A. | 探究Na与水反应可能有O2生成 | |
| B. | 探究Na2O2与SO2反应可能有Na2SO4生成 | |
| C. | 探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能含有CuS | |
| D. | 探究向滴有酚酞的NaOH溶液中通入Cl2,溶液红色褪去的原因是溶液酸碱性改变所致,还是HClO的漂白性所致 |
| A. | 赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 | |
| B. | 纤维素、PLA(聚乳酸)、维生素C、硝化纤维等都是高分子化合物 | |
| C. | 高容量的储氢材料的研制是推广应用燃料电池的关键问题之一 | |
| D. | 将呼吸产生的二氧化碳用石灰水吸收符合”低碳经济“原则 |
 通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:
通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:①称取15.000g氢氧化钠固体样品,加水溶解,配成200mL溶液;
②用4.80%(密度是1.02g/mL)的盐酸滴定.以下是实验数据记录表:
| 实验序号 | 待测样品溶液体积(mL) | 滴定管读数 | 消耗标准盐酸溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.95 | 19.95 |
| 2 | 20.00 | 0.05 | 19.90mL | 19.85mL |
(2)计算4.80%(密度是1.02g/mL)盐酸的物质的量浓度(精确至0.0001).
(3)计算氢氧化钠固体样品中氢氧化钠的质量分数.
| A. | 正极 被还原 | B. | 正极 被氧化 | C. | 负极 被还原 | D. | 负极 被氧化 |
| A. | 现代元素周期表是按照元素相对原子质量由小到大排列而成的 | |
| B. | 同主族的元素,都是按从上到下的顺序电子层数逐渐增多 | |
| C. | 同周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8 | |
| D. | 同周期的元素的原子和离子半径,都是按从左到右的顺序逐渐减小 |
 .
. ,写出另一种盐的电子式
,写出另一种盐的电子式 .
.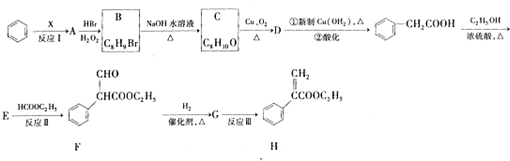
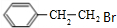 ;E的分子式为C10H12O2;F中含氧官能团的名称是醛基和酯基.
;E的分子式为C10H12O2;F中含氧官能团的名称是醛基和酯基. .
. 制备
制备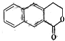 的合成路线
的合成路线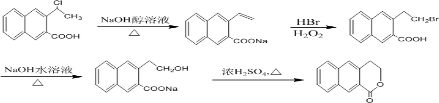 .
.