题目内容
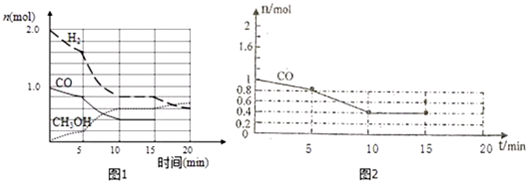
16.铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药物,图1是它的说明书:该药品中Fe2+会缓慢氧化,国家规定该药物中Fe2+的氧化率超过10%即不能再服用.
(1)为了检验某药店出售的“速力菲”是否被氧化,实验室可选用的最常用最灵敏的检验试剂为硫氰化钾溶液(填试剂的名称).
(2)实验室采用H2SO4酸化的KMnO4溶液对“速力菲”中的Fe2+进行滴定(假设药品中其他成分不与KMnO4反应);该反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
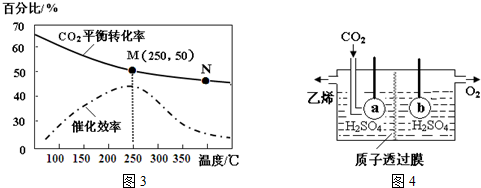
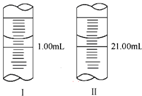
(3)称量上述含铁元素质量分数为20.00%的“速力菲”20.00g,将其全部溶于稀硫酸中,配制成1 000.00mL溶液.取出20.00mL,用0.01mol/L的KMnO4溶液滴定,消耗KMnO4溶液体积如图2所示.
①仪器A的名称是酸式滴定管:由图2可知消耗KMnO4溶液体积为19.00 mL;
②滴定终点观察到的现象为滴入最后一滴KMnO4溶液,溶液由无色变为紫红色,且半分钟不褪色;
③以标准KMnO4溶液滴定样品溶液的浓度,判断以下操作所引起实验结果偏小的是A.
A.滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出
B.滴定前俯视,滴定后仰视(标准液)
C.滴定接近终点时,用少量蒸馏水冲洗瓶内壁
D.未用标准KMnO4溶液润洗滴定管
④该药品可以服用吗?不可以(填“可以”或“不可以”)
分析 (1)根据Fe2+氧化会生成成Fe3+,即检验Fe3+的存在;
(2)MnO4-具有氧化性能将Fe2+氧化生成Fe3+,自身被还原成Mn2+,根据化合价升降总数相等、质量守恒以及电荷守恒配平;
(3)①根据仪器的结构和用途来解答;根据滴定管的结构、精确度以及测量原理来解答;
②酸性KMnO4溶液为紫红色,滴定终点时无色变为紫红色;
③根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
④根据关系式:MnO4-~5Fe2+,利用KMnO4的物质的量来求出1000.00mL溶液含有的Fe2+的物质的量,然后求出Fe2+ 的氧化率来解答.
解答 解:(1)Fe2+氧化会生成成Fe3+,可用硫氰化钾溶液检验Fe3+的存在,溶液变成血红色;
故答案为:硫氰化钾溶液;
(2)MnO4-具有氧化性能将Fe2+氧化生成Fe3+,自身被还原成Mn2+,反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;
故答案为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;
(3)①仪器A的名称是酸式滴定管;滴定管滴定前后读数为:0.80mL,19.80mL,消耗KMnO4溶液体积为19.80mL-0.80mL=19.00mL;
故答案为:酸式滴定管;19.00mL;
②KMnO4溶液呈紫红色,草酸反应完毕,滴入最后一滴KMnO4溶液,溶液由无色变为紫红色,且半分钟不褪色为滴定到终点,
故答案为:滴入最后一滴KMnO4溶液,溶液由无色变为紫红色,且半分钟不褪色;
③A.滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏小,故A正确;
B.滴定前俯视,滴定后仰视(标准液),造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故B错误;
C.滴定接近终点时,用少量蒸馏水冲洗瓶内壁,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)不变,故C错误;
D.未用标准KMnO4溶液润洗滴定管,溶液被稀释,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故D错误;
故选A.
④由MnO4-~5Fe2+,可得1000.00mL溶液含有的Fe2+的物质的量n(Fe2+)=0.01mol/L×19.00×10-3L×$\frac{1000.00mL}{20.00mL}$×5=0.0475mol,m(Fe2+)=0.0475mol×56g/mol=2.66g,Fe2+的氧化率$\frac{20.00g×20.00%-2.66g}{20.00g×20.00%}$=33.5%>10%,所以不可以服用;
故答案为:不可以.
点评 本题主要考查氧化还原滴定,增加了学生分析问题的能力,强调了学生整合知识的能力,本题难度中等.

| A. | 天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子 | |
| B. | 食用地沟油对人体的危害极大,原因主要是里面含有黄曲霉素和甘油三酯 | |
| C. | 地球上CH4、CO2等气体含量上升容易导致温室效应,进而引发灾难性气候 | |
| D. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
| 实验 编号 | 实验目的 | 温度/℃ | 催化剂 质量/g | 反应物初始浓度 /10-3mol•L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | ① | 420 | ② | 7 | 9 |
| Ⅲ | 探究催化剂对该反应速率的影响 | ③ | 10 | 7 | 9 |
(2)实验Ⅰ中,I2的物质的量浓度(c)随时间(t)的变化如图所示.
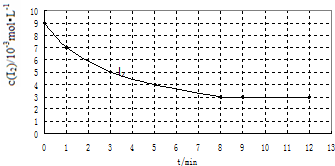
根据图中数据回答下列问题:
①在0~5min内反应的平均速率v(I2)=1×10-3mol•L-1•min-1.
②该温度下,反应的平衡常数K=$\frac{{c}^{2}(HI)}{c({H}_{2})×c({I}_{2})}$=48.(前空写表达式,后空写计算所得的数据)
③该同学还想用此反应研究压强对化学平衡移动的影响,请问能否达到实验目的?请说明原因.
不能(填“能”、不能”),原因是该反应前后气体计量数相等,平衡不受压强的影响.
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:(1)配制100mL 0.10mol/L NaOH标准溶液.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
②根据上述数据,计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字)
③下列操作(其他操作正确)会造成实验测定结果偏高的有DF.(多选扣分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失
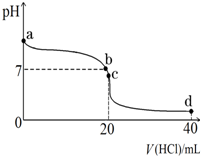
(3)室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
①NH3•H2O的电离方程式是NH3•H2O?NH4++OH-.
②b点所示溶液中的溶质是NH4Cl、NH3?H2O.
③c点所示溶液中,离子浓度从大到小的关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-),在该溶液中存在多种守恒关系,其中c(NH4+)+c(H+)=c(Cl-)+c(OH-)(用离子浓度表示).
| A. | Na、Mg、Al还原性依次增强 | |
| B. | HCl、PH3、H2S稳定性依次减弱 | |
| C. | NaOH、KOH、Ca(OH)2碱性依次减弱 | |
| D. | S2-、Cl-、K+、Ca2+离子半径依次减小 |
 .
.
 分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.
分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.