题目内容
3. 通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:
通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:①称取15.000g氢氧化钠固体样品,加水溶解,配成200mL溶液;
②用4.80%(密度是1.02g/mL)的盐酸滴定.以下是实验数据记录表:
| 实验序号 | 待测样品溶液体积(mL) | 滴定管读数 | 消耗标准盐酸溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.95 | 19.95 |
| 2 | 20.00 | 0.05 | 19.90mL | 19.85mL |
(2)计算4.80%(密度是1.02g/mL)盐酸的物质的量浓度(精确至0.0001).
(3)计算氢氧化钠固体样品中氢氧化钠的质量分数.
分析 (1)根据滴定管的结构、精确度以及量取的体积是两次读数之差;
(2)根据c=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度;
(3)根据HCl+NaOH=NaCl+H2O计算NaOH的物质的量,然后求出质量分数.
解答 解:(1)滴定管液面读数为19.90mL,消耗标准NaOH溶液的体积为19.90mL-0.05mL=19.85mL,
故答案为:19.90mL;19.85mL;
(2)4.80%(密度是1.02g/mL)盐酸的物质的量浓度c(HCl)=$\frac{1000ρω}{M}$=$\frac{1.02×1000×0.0480}{36.5}$=1.3414mol/L;
答:盐酸的浓度为1.3414mol/L;
(3)HCl+NaOH=NaCl+H2O
1 1
1.3414mol/L×0.01985L n(NaOH)
所以n(NaOH)=1.3414×0.01985mol
氢氧化钠固体样品中氢氧化钠的质量分数为$\frac{1.3414×0.01985mol×40g/mol×\frac{200mL}{20mL}}{15.000g}$×100%=71.0%;
答:质量分数为71.0%.
点评 本题主要考查了物质含量的测定,难度不大,只要掌握对应知识即可完成,注意c=$\frac{1000ρω}{M}$计算是重要知识点.

练习册系列答案
相关题目
18.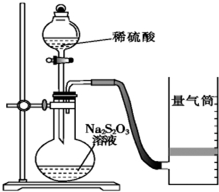 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+═H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图装置所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法:测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化 (写一种).
Ⅱ.为探讨反应物浓度对化学反应速率的影响,设计的实验方案如表.
(已知 I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
(4)该实验进行的目的是探究反应物浓度(Na2S2O3)对化学反应速率的影响淀粉溶液的作用是作为显色剂,检验I2的存在.表中Vx═4ml,比较t1、t2、t3大小,试推测该实验结论:t1<t2<t3.
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+═H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图装置所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法:测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化 (写一种).
Ⅱ.为探讨反应物浓度对化学反应速率的影响,设计的实验方案如表.
(已知 I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | |
12.能用酸性高锰酸钾溶液鉴别的一组物质是( )
| A. | 己烷和苯 | B. | 乙烯和乙炔 | C. | 乙醇和乙醛 | D. | 甲苯和苯 |
13.元素X、Y、Z、W、M、N的原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者的原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,Z2X4可以作火箭燃料,X2W2为18电子分子.均含X、W、M、N四种元素的两种常见化合物相互反应有带刺激性气味的气体放出.下列叙述错误的是( )
| A. | Y位于元素周期表的第2周期第IVA族 | |
| B. | X、Y、Z、W、M的原子半径由大到小的顺序为M>Y>Z>W>X | |
| C. | X、Z、W形成的盐中只含有离子键 | |
| D. | 产生刺激性气味气体的反应离子方程式为H++HSO3-=H2O+SO2↑ |

 分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.
分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.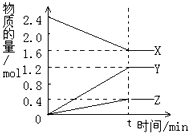 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示: