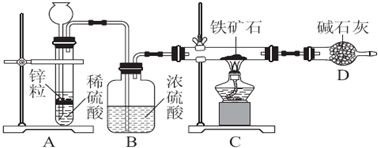
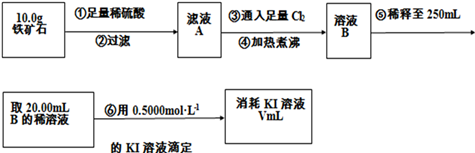
题目内容
20.已知空气-锌电池的电极反应为,锌片:Zn+2OH--2e-═ZnO+H2O;碳棒:O2+2H2O+4e-═4OH-,据此判断,锌片是( )| A. | 正极 被还原 | B. | 正极 被氧化 | C. | 负极 被还原 | D. | 负极 被氧化 |
分析 原电池中,负极失去电子发生还原反应,正极得到电子发生还原反应,根据电极反应式中得失电子情况可判断锌片正负极及发生反应的类型.
解答 解:在空气-锌电池中锌片发生反应为:Zn+2OH--2e-═ZnO+H2O,则锌为该原电池负极,失去电子发生氧化反应,在反应中被氧化,
故选D.
点评 本题考查了原电池工作原理,题目难度不大,正确判断原电池正负极为解答关键,注意掌握氧化还原反应的实质与特征,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
11.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程如图所示,下列叙述不正确的是( )

| A. | 铜中含有大量的有机物,可采用灼烧的方法除去有机物 | |
| B. | 灼烧后含有少量铜的可能原因是该条件下铜无法被氧气氧化 | |
| C. | 通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、蒸发、冷却结晶、过滤、自然干燥 | |
| D. | 与途径II相比,产生等量的胆矾途径I消耗硫酸少,途径I不会产生污染大气的气体 |
5.下列所述变化规律正确的是( )
| A. | Na、Mg、Al还原性依次增强 | |
| B. | HCl、PH3、H2S稳定性依次减弱 | |
| C. | NaOH、KOH、Ca(OH)2碱性依次减弱 | |
| D. | S2-、Cl-、K+、Ca2+离子半径依次减小 |
12.能用酸性高锰酸钾溶液鉴别的一组物质是( )
| A. | 己烷和苯 | B. | 乙烯和乙炔 | C. | 乙醇和乙醛 | D. | 甲苯和苯 |
10.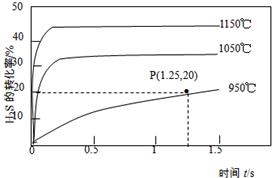 硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
 硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)<v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
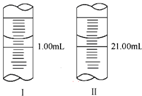 分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.
分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.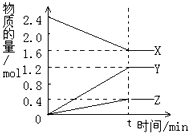 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示: