题目内容
11.下列结论正确的是( )| A. | 微粒半径:K+>Al3+>S2->Cl- | B. | 离子的还原性:S2->Cl->Br->I- | ||
| C. | 酸性:HClO>H2SO4>H3PO4>H2CO3 | D. | 金属性:K>Ca>Mg>Be |
分析 A.离子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
B.元素的非金属性越强,其简单阴离子的还原性越弱;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.同一主族元素,元素的金属性随着原子序数增大而增强,同一周期元素,元素的金属性随着原子序数增大而减弱.
解答 解:A.离子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以S2->Cl->K+>Al3+,故A错误;
B.元素的非金属性越强,其简单阴离子的还原性越弱,非金属性Cl>Br>I>S,所以离子的还原性:S2->I->Br->Cl-,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P>C,所以酸性:HClO4>H2SO4>H3PO4>H2CO3,但HClO是弱酸,所以这四种酸强弱顺序是H2SO4>H3PO4>H2CO3>HClO,故C错误;
D.同一主族元素,元素的金属性随着原子序数增大而增强,同一周期元素,元素的金属性随着原子序数增大而减弱,所以金属性K>Ca>Mg>Br,故D正确;
故选D.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素原子结构和元素周期律关系是解本题关键,熟练掌握并灵活运用元素周期律,题目难度不大.

练习册系列答案
相关题目
2.NA为阿伏加德罗常数,下列叙述正确的一组是( )
| A. | 由Cu.Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.4NA | |
| B. | 18 g D2O中含有的质子数目为10NA | |
| C. | 1 mol Cl2发生反应时,转移的电子数一定是2 NA | |
| D. | 常温常压下,16 g O3所含的原子数为NA |
19.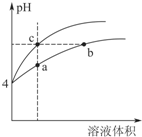 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因HCO3-+H2O?H2CO3+OH-.
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液.
其pH由大到小的顺序是:dcab(填序号).
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线如图4,其中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是b=c>a;该醋酸溶液稀释过程中,下列
各量一定变小的是bd.
a.c(OH-) b. c(H+)
c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ d.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)以0.10mol•L-1NaOH为标准液,测定某盐酸的浓度.取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.12mol•L-1 mol•L-1
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol•L-1,c(OH-)=10-b mol•L-1,已知a+b=13,则:
①该温度下水的离子积常数Kw=10-13mol2•L-2.
②在该温度下,将100mL0.1mol•L-1的稀H2SO4与100mL0.4mol•L-1的NaOH溶液混合后,溶液的pH=12.
 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因HCO3-+H2O?H2CO3+OH-.
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液.
其pH由大到小的顺序是:dcab(填序号).
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线如图4,其中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是b=c>a;该醋酸溶液稀释过程中,下列
各量一定变小的是bd.
a.c(OH-) b. c(H+)
c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ d.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)以0.10mol•L-1NaOH为标准液,测定某盐酸的浓度.取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | 氢氧化钠溶液的浓度 (mol•L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 24.12 | 20.00 |
| 2 | 0.10 | 23.88 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.12mol•L-1 mol•L-1
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol•L-1,c(OH-)=10-b mol•L-1,已知a+b=13,则:
①该温度下水的离子积常数Kw=10-13mol2•L-2.
②在该温度下,将100mL0.1mol•L-1的稀H2SO4与100mL0.4mol•L-1的NaOH溶液混合后,溶液的pH=12.
6.下列各组离子在指定的溶液中能大量共存的是( )
| A. | 酸性溶液中:K+、MnO4+、SO42-Cl- | |
| B. | 能使甲基橙显红色的溶液:Fe2+,NO3-,Na+,SO42- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=l0-12的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 酸性透明溶液中:Cu2+、Al3+、SO42-、NO3- |
16. 某研究性学习小组探究醋酸的溶液情况,进行了如下实验.
某研究性学习小组探究醋酸的溶液情况,进行了如下实验.
(1)取一定量的冰醋酸配制250mL 0.5000mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管.
(2)用上述0.5000mol•L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000mol•L-1的NaOH溶液对25.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的浓度为0.2000 mol•L-1.
(3)实验(2)中,滴定过程中pH变化曲线如图所示(室温下).
①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9.则混合溶液中:水的电离度是纯水的100倍;
c(OH-)-c(CH3COOH)=10-9mol•L-1.
 某研究性学习小组探究醋酸的溶液情况,进行了如下实验.
某研究性学习小组探究醋酸的溶液情况,进行了如下实验.(1)取一定量的冰醋酸配制250mL 0.5000mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管.
(2)用上述0.5000mol•L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000mol•L-1的NaOH溶液对25.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 25.05 | 25.00 | 23.80 | 24.95 |
(3)实验(2)中,滴定过程中pH变化曲线如图所示(室温下).
①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9.则混合溶液中:水的电离度是纯水的100倍;
c(OH-)-c(CH3COOH)=10-9mol•L-1.
3.电子层数相同的三种元素X、Y、Z它们的气态氢化物稳定性顺序为HX>H2Y>H3Z,下列判断错误的是( )
| A. | 离子半径X>Y>Z | |
| B. | 元素原子得电子能力X>Y>Z | |
| C. | 最高价氧化物对应水化物的酸性强弱X>Y>Z | |
| D. | 单质与氢气反应,X、Y、Z难度依次增大 |
20.常温时,将氢氟酸与NaOH溶液混合,所得溶液的pH=7,则此溶液中( )
| A. | c(Na+)>c(F-) | B. | c(Na+)<c(F-) | ||
| C. | c(Na+)=c(F-) | D. | 无法确定c(Na+)和c(F-)的大小关系 |