题目内容
20.常温时,将氢氟酸与NaOH溶液混合,所得溶液的pH=7,则此溶液中( )| A. | c(Na+)>c(F-) | B. | c(Na+)<c(F-) | ||
| C. | c(Na+)=c(F-) | D. | 无法确定c(Na+)和c(F-)的大小关系 |
分析 常温时,将氢氟酸与NaOH溶液混合,所得溶液的pH=7,则溶液中c(H+)=c(OH-),结合电荷守恒判断.
解答 解:常温时,将氢氟酸与NaOH溶液混合,所得溶液的pH=7,则溶液中c(H+)=c(OH-),由电荷守恒:c(Na+)+c(H+)=c(OH-)+c(F-),联立可得:c(Na+)=c(F-),
故选:C.
点评 本题考查离子浓度大小比较,难度不大,注意电荷守恒的思想在离子浓度大小比较中的应用.

练习册系列答案
相关题目
10. 常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
 常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )| A. | ①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)>c(C1-)>c(OH-)=c(H+) | |
| C. | ③溶液:c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 滴定过程中可能出现:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
11.下列结论正确的是( )
| A. | 微粒半径:K+>Al3+>S2->Cl- | B. | 离子的还原性:S2->Cl->Br->I- | ||
| C. | 酸性:HClO>H2SO4>H3PO4>H2CO3 | D. | 金属性:K>Ca>Mg>Be |
8.100℃时,KW=1.0×10-12,若在100℃时某溶液中的c(H+)=1.0×10-7 mol•L-1,则该溶液( )
| A. | 呈中性 | B. | 呈碱性 | C. | 呈酸性 | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1 |
15.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
(1)已知某反应的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,它所对应反应的化学方程式为C(s)+H2O(g) CO(g)+H2(g).
CO(g)+H2(g).
(2)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g)
该反应的平衡常数随温度的变化如表所示:
①该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2})?c({H}_{2})}{c(CO)?c({H}_{2}O)}$.
②该反应的正反应方向是放热反应(填“吸热”或“放热”);
③若在500℃时进行,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化为75%.
④800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”).
(3)2SO2(g)+O2(g)?2SO3(g)反应过程中的能量变化如图所示:
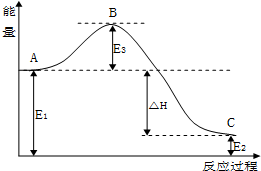
又已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1,请回答下列问题:
①图中E1、E2分别表示反应物总能、生成物总能量,E3的大小对该反应的反应热无(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点降低(填“升高”或“降低”)△H不变(填“变大”、“变小”或“不变”),理由是因为催化剂可以降低反应的活化能,但不改变反应热.
②图中△H=-198kJ•mol-1.
(1)已知某反应的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,它所对应反应的化学方程式为C(s)+H2O(g)
 CO(g)+H2(g).
CO(g)+H2(g).(2)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g)
该反应的平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
②该反应的正反应方向是放热反应(填“吸热”或“放热”);
③若在500℃时进行,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化为75%.
④800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”).
(3)2SO2(g)+O2(g)?2SO3(g)反应过程中的能量变化如图所示:

又已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1,请回答下列问题:
①图中E1、E2分别表示反应物总能、生成物总能量,E3的大小对该反应的反应热无(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点降低(填“升高”或“降低”)△H不变(填“变大”、“变小”或“不变”),理由是因为催化剂可以降低反应的活化能,但不改变反应热.
②图中△H=-198kJ•mol-1.
5.下列说法正确的是( )
| A. | 红磷转化为白磷,属于物理变化 | |
| B. | 石墨导电、金刚石不导电,故二者不是同素异形体 | |
| C. | O2和O3分子式不同,结构相同 | |
| D. | 单质硫有S2、S4、S6等,它们都是硫的同素异形体 |
12.下列说法正确的是( )
| A. | 元素周期表中短周期都是主族元素 | |
| B. | 原子核外在离核较远区域的电子易失去,其原因是这些电子的能量较高 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 对于吸收能量的反应必需加热才能发生 |
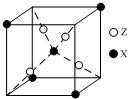 元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.
元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.