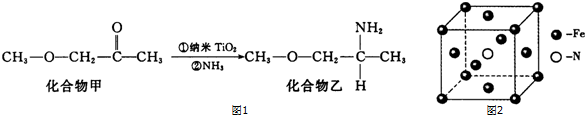
题目内容
19. 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因HCO3-+H2O?H2CO3+OH-.
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液.
其pH由大到小的顺序是:dcab(填序号).
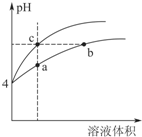
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线如图4,其中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是b=c>a;该醋酸溶液稀释过程中,下列
各量一定变小的是bd.
a.c(OH-) b. c(H+)
c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ d.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)以0.10mol•L-1NaOH为标准液,测定某盐酸的浓度.取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | 氢氧化钠溶液的浓度 (mol•L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 24.12 | 20.00 |
| 2 | 0.10 | 23.88 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.12mol•L-1 mol•L-1
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol•L-1,c(OH-)=10-b mol•L-1,已知a+b=13,则:
①该温度下水的离子积常数Kw=10-13mol2•L-2.
②在该温度下,将100mL0.1mol•L-1的稀H2SO4与100mL0.4mol•L-1的NaOH溶液混合后,溶液的pH=12.
分析 (1)①NaHCO3是强碱弱酸酸式盐,HCO3-水解程度大于电离程度导致溶液呈碱性;
②ab是盐,弱酸根离子水解导致溶液呈碱性;cd是可溶性强碱,溶液中c(OH-)越大,溶液的碱性越强;
(2)醋酸是弱酸,盐酸是强酸,pH相同的醋酸和盐酸,加水稀释过程中醋酸电离出氢离子导致稀释相同倍数时pH醋酸<盐酸,所以pH变化大的是盐酸、变化小的是醋酸,根据图知,上边曲线表示盐酸、下边曲线表示醋酸,
酸抑制水电离,酸中氢离子浓度越大其抑制水电离程度越大;
加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)、c(CH3COOH)、c(CH3COO-)都减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大;
(3)①如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
②先判断数据的合理性,求出标准NaOH溶液体积,然后依据c(待测)=$\frac{c(标准).V(标准)}{V(待测)}$求出即可;
(4)①溶液中的离子积Kw=C(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-13;
②根据混合溶液的酸碱性计算氢离子浓度,从而计算溶液的pH.
解答 解:(1)①NaHCO3是强碱弱酸酸式盐,HCO3-水解程度大于电离程度导致溶液呈碱性,水解离子方程式为HCO3-+H2O?H2CO3+OH-,故答案为:HCO3-+H2O?H2CO3+OH-;
②ab是盐,弱酸根离子水解导致溶液呈碱性,碳酸根离子水解程度大于醋酸根离子,所以碱性a>b;cd是可溶性强碱,溶液中c(OH-)越大,溶液的碱性越强,d中氢氧根离子浓度大于c,所以碱性d>c,
碱的碱性大于盐,所以pH大小顺序是d>c>a>b,故答案为:dcab;
(2)醋酸是弱酸,盐酸是强酸,pH相同的醋酸和盐酸,加水稀释过程中醋酸电离出氢离子导致稀释相同倍数时pH醋酸<盐酸,所以pH变化大的是盐酸、变化小的是醋酸,根据图知,上边曲线表示盐酸、下边曲线表示醋酸,
酸抑制水电离,酸中c(H+)越大其抑制水电离程度越大,根据图知,c(H+)a>b=c,所以抑制水电离程度a>b=c,则水的电离程度b=c>a;
加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)、c(CH3COOH)、c(CH3COO-)都减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大,
a.溶液中c(H+)、c(CH3COOH)、c(CH3COO-)都减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大,故错误;
b.水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+) 变小,故正确;c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c(C{H}_{3}COOH).c({H}^{+}).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}$=$\frac{{K}_{w}}{{K}_{a}}$,温度不变、离子积常数和电离平衡常数不变,所以该比值不变,故错误;
d.加水稀释促进醋酸电离,则醋酸的物质的量减小、氢离子物质的量增大,所以$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$减小,故正确;
故答案为:b=c>a;bd;
(3)①滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,即酚酞在酸中为无色,在碱性溶液中显浅红色,故答案为:最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色;
②得出V(标准)=$\frac{23.88+24.00+24.12}{3}$=24.00mL,c(待测)=$\frac{0.1mol/L×24.00mL}{20.00mL}$=0.12mol/L,故答案为:0.12mol/L;
c(待测)=$\frac{c(标准).V(标准)}{V(待测)}$求出即可;
(4)①溶液中的离子积Kw=C(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-13,故答案为:10-13;
②混合溶液中c(OH-)=$\frac{(0.4mol/L-0.1mol/L×2)×0.1L}{0.1L×2}$=0.1mol/L,该溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-13}}{0.1}$mol/L=10-12mol/L,则溶液的pH=-lg10-12=12,
故答案为:12.
点评 本题考查弱电解质的电离、酸碱混合溶液定性判断等知识点,侧重考查计算及分析能力,明确弱电解质电离特点是解本题关键,难点是有关溶液pH的计算,题目难度中等.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案| A. | 0.1mol•L-1NaHCO3溶液:H+、Al3+、Cl-、CH3COO- | |
| B. | 0.1mol•L-1CuCl2溶液:K+、NH4+、OH-、S2- | |
| C. | 0.1mol•L-1FeCl2溶液:Na+、NH4+、I-、SO42- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液:Fe3+、Na+、SO32ˉ、NO3- |
 常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )| A. | ①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)>c(C1-)>c(OH-)=c(H+) | |
| C. | ③溶液:c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 滴定过程中可能出现:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
| A. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 | |
| B. | 乙酸乙酯的制备实验中,饱和Na2CO3溶液不仅可以降低乙酸乙酯的溶解度,还能吸收挥发出来的乙醇及乙酸 | |
| C. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |

(1)装置E中反应方程式是CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+X↑,X的化学式是CH4.
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①B装置的作用是除去Cl2中含有的HCl;
②C装置所盛放试剂是饱和食盐水;光照后所得产物有CH3Cl、CH2Cl2、CHCl3、CCl4、HCl;
(3)设计一个实验方案,验证产物中生成了一种无机物:光照后,取C和D中液体各少许,分别加入两支试管中,再分别滴加2滴石蕊溶液,C中溶液红色更深;或用pH试纸测定C和D中溶液的pH等
(4)某学生为了测定X的组成进行实验探究,选用了下列仪器:

①该同学依次连接的合理顺序是E、G、H、F;
②该同学测定的相关数据是:
| 装置 | 实验前的质量/g | 实验后的质量/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
该测定含氢量是否有偏差?若有偏差,请说明原因F中吸收的是CO2,CO2质量33.6g-22.5g=11.1g,n(C)=$\frac{11.1g}{44g/mol}$=0.252mol;H中吸收的是水蒸气,H2O质量51.4g-42.4g=9.0g,n(H)=$\frac{9.0g}{18g/mol}$×2=1.0mol;
故n(C):n(H)>1:4.原因是F装置后面与空气接触,空气中的水蒸气和CO2进入了B装置,造成含碳量偏大.
| A. | 微粒半径:K+>Al3+>S2->Cl- | B. | 离子的还原性:S2->Cl->Br->I- | ||
| C. | 酸性:HClO>H2SO4>H3PO4>H2CO3 | D. | 金属性:K>Ca>Mg>Be |
| A. | 呈中性 | B. | 呈碱性 | C. | 呈酸性 | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1 |
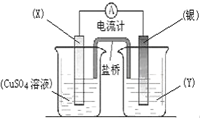 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.