题目内容
1.已知断开lmolH一H键吸收的能量为436kJ,形成lmolH一N键放出的能量为39lKJ,根据化学方程式N2+3H2$?_{催化剂}^{高温高压}$2NH3,反应完1mol N2放出的能量为92.4kJ,则断开1mol N≡N键需吸收的能量是( )| A. | 431kJ | B. | 945.6kJ | C. | 649kJ | D. | 869kJ |
分析 热化学方程式中,反应热=反应物的总键能-生成物的总键能,据此计算出断开1mol N≡N键吸收的能量.
解答 解:已知:H-H键能为436kJ/mol,H-N键能为391kJ/mol,设N≡N的键能为x,
对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
反应热=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol
解得:x=945.6 kJ/mol,则断开1mol N≡N键需吸收的能量是945.6kJ,
故选B.
点评 本题考查了反应热的有关计算、反应热与化学键键能的关系,题目难度不大,明确反应热与键能的关系是解答本题的关键.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
11.下列结论正确的是( )
| A. | 微粒半径:K+>Al3+>S2->Cl- | B. | 离子的还原性:S2->Cl->Br->I- | ||
| C. | 酸性:HClO>H2SO4>H3PO4>H2CO3 | D. | 金属性:K>Ca>Mg>Be |
12.下列说法正确的是( )
| A. | 元素周期表中短周期都是主族元素 | |
| B. | 原子核外在离核较远区域的电子易失去,其原因是这些电子的能量较高 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 对于吸收能量的反应必需加热才能发生 |
16.下列说法正确的是( )
| A. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| B. | 所有化学变化的能量都可以通过原电池转化为电能 | |
| C. | 所有化学变化一定遵循质量守恒和能量守恒 | |
| D. | 凡是需要加热的反应都是吸热反应 |
6.甲、乙是周期表中同一主族两种元素,若甲的原子序数为x,则乙的原子序数不可能( )
| A. | x+10 | B. | x+12 | C. | x+16 | D. | x+50 |
13.如图是元素周期表的一部分.表中所列的字母分别代表某一种化学元素.下列说法正确的是( )


| A. | 稳定性:A2D<A2X | |
| B. | CA3分子的立体结构为平面三角形 | |
| C. | C形成的单质中σ键与π键个数之比为1:2 | |
| D. | B、C、D形成的气态氢化物互为等电子体 |
11.下列分子中各原子最外层都满足8电子稳定结构的是( )
| A. | CH4 | B. | PCl5 | C. | CCl4 | D. | SF6 |
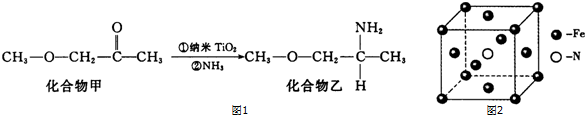
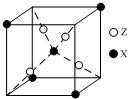 元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.
元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.