题目内容
2.NA为阿伏加德罗常数,下列叙述正确的一组是( )| A. | 由Cu.Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.4NA | |
| B. | 18 g D2O中含有的质子数目为10NA | |
| C. | 1 mol Cl2发生反应时,转移的电子数一定是2 NA | |
| D. | 常温常压下,16 g O3所含的原子数为NA |
分析 A.0.2g氢气的物质的量为0.1mol,生成0.1mol氢气转移了0.2mol电子;
B.重水的摩尔质量为20g/mol;
C.氯气反应可以只做氧化剂,也可以自身氧化还原反应;
D.质量转换成物质的量,结合臭氧是由氧原子构成解答.
解答 解:A.0.2g氢气的物质的量为0.1mol,生成0.1mol氢气转移了0.2mol电子,根据电子守恒,则电路通过电子0.2NA,故A错误;
B.重水的摩尔质量为20g/mol,故18g重水的物质的量为0.9mol,故含9NA个质子,故B错误;
C.1molCl2发生反应时,只做氧化剂,转移的电子数一定2NA,自身氧化还原反应转移电子1mol,故C错误;
D.常温常压下,16 g O3所含的原子数为$\frac{16g}{16g/mol}$×NA=NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的应用,掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系是解题关键,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
9.短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示,下列说法一定正确的是( )

| A. | 最高正化合价:Z>X | |
| B. | X、Y、Z的单质中,Z的熔点最高 | |
| C. | 若X为非金属元素,则离子半径:Xn->Ym->Zm- | |
| D. | X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强 |
13.(1)室温下,有一pH=12的NaOH溶液100mL,欲使它的pH降为11.
①如果加入蒸馏水,就加入900 mL
②如果加入pH=10的NaOH溶液,应加入1000 mL
③如果加入0.008mol/L HCl溶液,应加入100 mL
(2)实验室在配制溶液时,一些物质存在水解的情况,如在配制Na2CO3溶液时,CO32-会水解,请书写水解离子方程式CO32-+H2O?HCO3-+OH-,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式Al3++3H2O?Al(OH)3+3H+,为了防止Al2(SO4)3发生水解,可加入少量的硫酸.
(3)工业上用氧化铜制备氯化铜时,先将制的氧化铜(含有杂质FeO)用浓酸溶解得到的氯化铜(溶液中含有一定量的Fe2+).
实际生产中先用次氯酸钠将Fe2+氧化成Fe3+,然后用试剂CuO或Cu(OH)2将溶液PH值调至3.7~4.4,即可除去铁杂质.
①如果加入蒸馏水,就加入900 mL
②如果加入pH=10的NaOH溶液,应加入1000 mL
③如果加入0.008mol/L HCl溶液,应加入100 mL
(2)实验室在配制溶液时,一些物质存在水解的情况,如在配制Na2CO3溶液时,CO32-会水解,请书写水解离子方程式CO32-+H2O?HCO3-+OH-,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式Al3++3H2O?Al(OH)3+3H+,为了防止Al2(SO4)3发生水解,可加入少量的硫酸.
(3)工业上用氧化铜制备氯化铜时,先将制的氧化铜(含有杂质FeO)用浓酸溶解得到的氯化铜(溶液中含有一定量的Fe2+).
| 金属离子 | PH值 | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
10. 常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
 常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )| A. | ①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)>c(C1-)>c(OH-)=c(H+) | |
| C. | ③溶液:c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 滴定过程中可能出现:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
17.选用适当的试剂和除杂方法除去下列各物质中的杂质(括号中为杂质),将所选试剂和操作的名称填写在表格中.
| 序号 | 物质 | 试剂 | 除杂方法 |
| ① | 甲烷(C2H4) | ||
| ② | 硝基苯(混合酸) | ||
| ③ | KNO3(NaCl) |
7.下列说法不正确的是( )
| A. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 | |
| B. | 乙酸乙酯的制备实验中,饱和Na2CO3溶液不仅可以降低乙酸乙酯的溶解度,还能吸收挥发出来的乙醇及乙酸 | |
| C. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
11.下列结论正确的是( )
| A. | 微粒半径:K+>Al3+>S2->Cl- | B. | 离子的还原性:S2->Cl->Br->I- | ||
| C. | 酸性:HClO>H2SO4>H3PO4>H2CO3 | D. | 金属性:K>Ca>Mg>Be |
12.下列说法正确的是( )
| A. | 元素周期表中短周期都是主族元素 | |
| B. | 原子核外在离核较远区域的电子易失去,其原因是这些电子的能量较高 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 对于吸收能量的反应必需加热才能发生 |
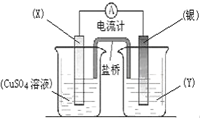 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.