题目内容
3.电子层数相同的三种元素X、Y、Z它们的气态氢化物稳定性顺序为HX>H2Y>H3Z,下列判断错误的是( )| A. | 离子半径X>Y>Z | |
| B. | 元素原子得电子能力X>Y>Z | |
| C. | 最高价氧化物对应水化物的酸性强弱X>Y>Z | |
| D. | 单质与氢气反应,X、Y、Z难度依次增大 |
分析 电子层数相同的三种元素X、Y、Z,说明它们属于同一周期元素,同一周期元素,非金属性随着原子序数增大而增强,元素的非极性越强,其氢化物的稳定性越强,因为它们的气态氢化物稳定性顺序为HX>H2Y>H3Z,所以原子序数X>Y>Z,非金属性X>Y>Z,
A.电子层结构相同的离子,离子半径随着原子序数增大而减小;
B.元素的非金属性越强,其原子得电子能力越强;
C.元素的非极性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
D.元素的非金属性越强,其单质与氢气越容易化合.
解答 解:电子层数相同的三种元素X、Y、Z,说明它们属于同一周期元素,同一周期元素,非金属性随着原子序数增大而增强,元素的非极性越强,其氢化物的稳定性越强,因为它们的气态氢化物稳定性顺序为HX>H2Y>H3Z,所以原子序数X>Y>Z,非金属性X>Y>Z,
A.电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径X<Y<Z,故A错误;
B.元素的非金属性越强,其原子得电子能力越强,非金属性X>Y>Z,所以元素原子得电子能力X>Y>Z,故B正确;
C.元素的非极性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,如果X是F、Y是O元素,二者没有最高价氧化物的水化物,故C错误;
D.元素的非金属性越强,其单质与氢气越容易化合,非金属性X>Y>Z,所以单质与氢气反应X、Y、Z难度依次增大,故D正确;
故选AC.
点评 本题考查原子结构和元素周期律,为高频考点,明确同一周期原子结构和元素周期律的关系是解本题关键,注意规律中的反常现象,易错选项是C,O、F元素没有最高价氧化物的水化物,

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
13.(1)室温下,有一pH=12的NaOH溶液100mL,欲使它的pH降为11.
①如果加入蒸馏水,就加入900 mL
②如果加入pH=10的NaOH溶液,应加入1000 mL
③如果加入0.008mol/L HCl溶液,应加入100 mL
(2)实验室在配制溶液时,一些物质存在水解的情况,如在配制Na2CO3溶液时,CO32-会水解,请书写水解离子方程式CO32-+H2O?HCO3-+OH-,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式Al3++3H2O?Al(OH)3+3H+,为了防止Al2(SO4)3发生水解,可加入少量的硫酸.
(3)工业上用氧化铜制备氯化铜时,先将制的氧化铜(含有杂质FeO)用浓酸溶解得到的氯化铜(溶液中含有一定量的Fe2+).
实际生产中先用次氯酸钠将Fe2+氧化成Fe3+,然后用试剂CuO或Cu(OH)2将溶液PH值调至3.7~4.4,即可除去铁杂质.
①如果加入蒸馏水,就加入900 mL
②如果加入pH=10的NaOH溶液,应加入1000 mL
③如果加入0.008mol/L HCl溶液,应加入100 mL
(2)实验室在配制溶液时,一些物质存在水解的情况,如在配制Na2CO3溶液时,CO32-会水解,请书写水解离子方程式CO32-+H2O?HCO3-+OH-,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式Al3++3H2O?Al(OH)3+3H+,为了防止Al2(SO4)3发生水解,可加入少量的硫酸.
(3)工业上用氧化铜制备氯化铜时,先将制的氧化铜(含有杂质FeO)用浓酸溶解得到的氯化铜(溶液中含有一定量的Fe2+).
| 金属离子 | PH值 | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
11.下列结论正确的是( )
| A. | 微粒半径:K+>Al3+>S2->Cl- | B. | 离子的还原性:S2->Cl->Br->I- | ||
| C. | 酸性:HClO>H2SO4>H3PO4>H2CO3 | D. | 金属性:K>Ca>Mg>Be |
8.100℃时,KW=1.0×10-12,若在100℃时某溶液中的c(H+)=1.0×10-7 mol•L-1,则该溶液( )
| A. | 呈中性 | B. | 呈碱性 | C. | 呈酸性 | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1 |
15.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
(1)已知某反应的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,它所对应反应的化学方程式为C(s)+H2O(g) CO(g)+H2(g).
CO(g)+H2(g).
(2)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g)
该反应的平衡常数随温度的变化如表所示:
①该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2})?c({H}_{2})}{c(CO)?c({H}_{2}O)}$.
②该反应的正反应方向是放热反应(填“吸热”或“放热”);
③若在500℃时进行,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化为75%.
④800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”).
(3)2SO2(g)+O2(g)?2SO3(g)反应过程中的能量变化如图所示:
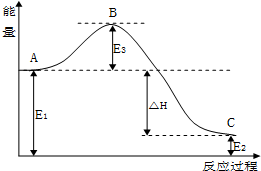
又已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1,请回答下列问题:
①图中E1、E2分别表示反应物总能、生成物总能量,E3的大小对该反应的反应热无(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点降低(填“升高”或“降低”)△H不变(填“变大”、“变小”或“不变”),理由是因为催化剂可以降低反应的活化能,但不改变反应热.
②图中△H=-198kJ•mol-1.
(1)已知某反应的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,它所对应反应的化学方程式为C(s)+H2O(g)
 CO(g)+H2(g).
CO(g)+H2(g).(2)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g)
该反应的平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
②该反应的正反应方向是放热反应(填“吸热”或“放热”);
③若在500℃时进行,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化为75%.
④800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”).
(3)2SO2(g)+O2(g)?2SO3(g)反应过程中的能量变化如图所示:

又已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1,请回答下列问题:
①图中E1、E2分别表示反应物总能、生成物总能量,E3的大小对该反应的反应热无(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点降低(填“升高”或“降低”)△H不变(填“变大”、“变小”或“不变”),理由是因为催化剂可以降低反应的活化能,但不改变反应热.
②图中△H=-198kJ•mol-1.
12.下列说法正确的是( )
| A. | 元素周期表中短周期都是主族元素 | |
| B. | 原子核外在离核较远区域的电子易失去,其原因是这些电子的能量较高 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 对于吸收能量的反应必需加热才能发生 |
13.如图是元素周期表的一部分.表中所列的字母分别代表某一种化学元素.下列说法正确的是( )


| A. | 稳定性:A2D<A2X | |
| B. | CA3分子的立体结构为平面三角形 | |
| C. | C形成的单质中σ键与π键个数之比为1:2 | |
| D. | B、C、D形成的气态氢化物互为等电子体 |
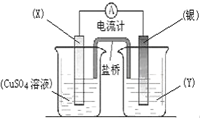 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.


