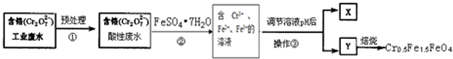
题目内容
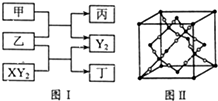 W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题:
W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题:(1)甲与乙反应的化学方程式是
(2)甲的中心原子杂化轨道类型为
(3)W、X、Y、Z四种元素电负性由大到小的顺序是
(4)工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是
考点:无机物的推断
专题:推断题
分析:常温下0.01mol/L-1丙溶液pH=12,为强碱溶液,可推知丙为NaOH,化合物甲与乙反应得到氢氧化钠与单质Y2,应是过氧化钠与水反应生成氢氧化钠与氧气,则Y2为O2;XY2分子是非极性分子,能与乙反应得到氧气与丁,则乙为Na2O2、XY2为CO2,丁为Na2CO3,甲为H2O,W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,故W为H元素、X为C元素、Y为O元素、Z为Na元素,据此解答.
解答:
解:常温下0.01mol/L-1丙溶液pH=12,为强碱溶液,可推知丙为NaOH,化合物甲与乙反应得到氢氧化钠与单质Y2,应是过氧化钠与水反应生成氢氧化钠与氧气,则Y2为O2;XY2分子是非极性分子,能与乙反应得到氧气与丁,则乙为Na2O2、XY2为CO2,丁为Na2CO3,甲为H2O,W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,故W为H元素、X为C元素、Y为O元素、Z为Na元素,
(1)甲与乙反应是水与过氧化钠反应生成氢氧化钠与氧气,反应的化学方程式是:2Na2O2+2H2O═4NaOH+O2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(2)甲为H2O,中心O原子成2个O-H键、含有2对孤电子对,杂化轨道数目为4,杂化轨道类型为sp3,CO2分子结构式为O=C=O,σ键与π键的数目之比为1:1;CO2原子晶体晶胞含有原子数目=5×4+8×
+6×
=24,
故答案为:sp3;1:1;24;
(3)同周期自左而右电负性增大,非金属性越强电负性越大,金属性越强电负性越小,故电负性:O>C>H>Na,
故答案为:O>C>H>Na;
(4)工业上用氯气与潮湿的碳酸钠反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,次氯酸的酸酐为Cl2O,反应方程式为:2Cl2+2Na2CO3+H2O═2NaCl+2NaHCO3+Cl2O,
故答案为:2Cl2+2Na2CO3+H2O═2NaCl+2NaHCO3+Cl2O.
(1)甲与乙反应是水与过氧化钠反应生成氢氧化钠与氧气,反应的化学方程式是:2Na2O2+2H2O═4NaOH+O2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(2)甲为H2O,中心O原子成2个O-H键、含有2对孤电子对,杂化轨道数目为4,杂化轨道类型为sp3,CO2分子结构式为O=C=O,σ键与π键的数目之比为1:1;CO2原子晶体晶胞含有原子数目=5×4+8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:sp3;1:1;24;
(3)同周期自左而右电负性增大,非金属性越强电负性越大,金属性越强电负性越小,故电负性:O>C>H>Na,
故答案为:O>C>H>Na;
(4)工业上用氯气与潮湿的碳酸钠反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,次氯酸的酸酐为Cl2O,反应方程式为:2Cl2+2Na2CO3+H2O═2NaCl+2NaHCO3+Cl2O,
故答案为:2Cl2+2Na2CO3+H2O═2NaCl+2NaHCO3+Cl2O.
点评:本题考查无机物推断,丙溶液pH值是推断突破口,结合乙与甲反应生成丙与气体单质推断,难度中等.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
H2SO3水溶液中存在电离平衡H2SO3?H++HSO3-和HSO3-?H++SO32-,若向H2SO3溶液中( )
| A、通入氯气,溶液中氢离子浓度增大 |
| B、通入过量H2S,反应后溶液pH减小 |
| C、加入氢氧化钠溶液,平衡向右移动,pH变小 |
| D、加入氯化钡溶液,平衡向右移动,会产生亚硫酸钡沉淀 |
25℃时,水的电离达到平衡;H2O?H-+OH-△H>0,下列叙述正确的是( )
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H-)降低 |
| C、向水中加入少量固体氢氧化钠,平衡正向移动,c(H-)降低 |
| D、将水加热,KW增大,pH不变 |
对于同一周期从左到右的主族元素,下列说法中正确的是( )
| A、原子半径逐渐减小 |
| B、元素的金属性逐渐增强 |
| C、最高正化合价逐渐增大 |
| D、单质的熔沸点逐渐降低 |
下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
A、异戊二烯(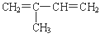 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 |
| B、CH3CH2CH2Cl在碱性溶液中水解 |
| C、甲苯在一定条件下发生硝化生成一硝基甲苯的反应 |
| D、2-氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应 |