题目内容
25℃时,水的电离达到平衡;H2O?H-+OH-△H>0,下列叙述正确的是( )
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H-)降低 |
| C、向水中加入少量固体氢氧化钠,平衡正向移动,c(H-)降低 |
| D、将水加热,KW增大,pH不变 |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:水的电离平衡:H2O?H++OH-中,要使平衡发生移动,应改变溶液c(H+)或c(OH-)的浓度,水的电离是吸热过程,升高温度,平衡向电离方向移动,K增大,c(H+),则pH减小.
解答:
解:A、向水中加入稀氨水是弱碱抑制水的电离,平衡逆向移动,c(OH-)增大,故A错误;
B、向水中加入少量固体硫酸氢钠溶解后相当于一元酸,抑制水的电离平衡,平衡逆向移动,c(H+)增大,故B错误;
C、向水中加入少量固体氢氧化钠抑制水的电离,平衡逆向进行,c(H+)减小,温度不变KW不变,故C正确;
D、水的电离是吸热过程,将水加热,促进水的电离,KW增大,氢离子浓度增大,pH减小,故D错误;
故选C.
B、向水中加入少量固体硫酸氢钠溶解后相当于一元酸,抑制水的电离平衡,平衡逆向移动,c(H+)增大,故B错误;
C、向水中加入少量固体氢氧化钠抑制水的电离,平衡逆向进行,c(H+)减小,温度不变KW不变,故C正确;
D、水的电离是吸热过程,将水加热,促进水的电离,KW增大,氢离子浓度增大,pH减小,故D错误;
故选C.
点评:本题考查了水的电离平衡的影响因素分析和水的离子积的条件判断和计算应用,主要是抑制水的电离的溶液可以是酸也可以是碱溶液,题目较简单.

练习册系列答案
相关题目
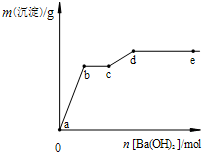 在含有4mol HCl和1mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法正确的是( )
在含有4mol HCl和1mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法正确的是( )| A、a→b时的沉淀的成分为BaSO4与Mg(OH)2 |
| B、b→c时发生的离子反应为:H++OH-→H2O |
| C、c→d时离子的物质的量:Ba2+可能大于Cl- |
| D、d→e时离子的物质的量:Ba2+一定大于OH- |
下列说法正确的是( )
| A、电子层数越多,原子半径一定越大 | ||||
B、已知2C+SiO2
| ||||
| C、第ⅥA族元素的氢化物中,稳定性最强的其沸点最低 | ||||
| D、按照元素周期表的排布规律,非金属元素最多为23种 |
在合成氨工业中,实现下列目的变化过程中与平衡移动无关的是( )
| A、为增加NH3的日产量,不断将NH3分离出来 |
| B、为增加NH3的日产量,使用催化剂 |
| C、为增加NH3的日产量,采用500℃左右的高温 |
| D、为增加NH3的日产量,采用2×107-5×107Pa的压强 |
下列属于电解质的是( )
| A、稀硫酸 | B、酒精 | C、铜 | D、小苏打 |
香叶醛分子的结构简式如图所示.下列叙述正确的是( )
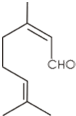

| A、1 mol香叶醛发生加成反应需要2 mol H2 |
| B、香叶醛不能与溴发生反应 |
| C、香叶醛能与钠发生反应生成H2 |
| D、香叶醛能发生银镜反应 |
在2A(g)+5B(g)?2C(g)+3D(g)反应中,下列反应速率最快的是( )
| A、υ(A)=0.8 mol/(L?s) |
| B、υ(B)=1.0 mol/(L?s) |
| C、υ(C)=1.8 mol/(L?min) |
| D、υ(D)=0.9 mol/(L?s) |
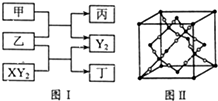 W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题:
W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题: