题目内容
氮的化合物是中学化学的重要物质,与人类生活密切相关.

(1)金属与不同密度的硝酸溶液反应所得的还原产物比较复杂,如图1所示:
请写出铁与密度为1.35g?mL-1的硝酸反应的化学方程式: .
(2)亚硝酸钠是一种致癌物质,它在中性或碱性条件下是稳定的,酸化后能氧化碘化钾生成棕色溶液和NO,则该反应中氧化剂与还原剂的物质的量之比为 .
(3)如图2为NO2和C0反应生成CO2和NO过程的能量变化示意图,请写出该反应的热化学方程式: .
(4)已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图3所示.
①前10min内用NO2表示的平均反应速率v(NO2)= mol?L-1?min-1;上述反应的平衡常数K= .
②反应进行至25min时,曲线发生变化的原因是 .
③若要使上述反应的平衡常数K增大,采取的措施是 .
A.加入催化剂 B.缩小容器体积 C.降低温度 D.再加入一定量的NO2.

(1)金属与不同密度的硝酸溶液反应所得的还原产物比较复杂,如图1所示:
请写出铁与密度为1.35g?mL-1的硝酸反应的化学方程式:
(2)亚硝酸钠是一种致癌物质,它在中性或碱性条件下是稳定的,酸化后能氧化碘化钾生成棕色溶液和NO,则该反应中氧化剂与还原剂的物质的量之比为
(3)如图2为NO2和C0反应生成CO2和NO过程的能量变化示意图,请写出该反应的热化学方程式:
(4)已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图3所示.
①前10min内用NO2表示的平均反应速率v(NO2)=
②反应进行至25min时,曲线发生变化的原因是
③若要使上述反应的平衡常数K增大,采取的措施是
A.加入催化剂 B.缩小容器体积 C.降低温度 D.再加入一定量的NO2.
考点:硝酸的化学性质,热化学方程式,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)铁与密度为1.35g?mL-1的硝酸反应生成硝酸铁、二氧化氮和一氧化氮、水;
(2)酸性条件下,亚硝酸和碘化钾反应生成碘和NO、硝酸钾;
(3)NO2和C0反应生成CO2和NO且放出热量;
(4)①根据图象中物质浓度变化知,反应物是四氧化二氮、生成物是二氧化氮,根据v=
计算;平衡常数K=
;
②反应进行至25min时,反应物和生成物浓度都减少,说明容器体积增大;
③化学平衡常数只与温度有关.
(2)酸性条件下,亚硝酸和碘化钾反应生成碘和NO、硝酸钾;
(3)NO2和C0反应生成CO2和NO且放出热量;
(4)①根据图象中物质浓度变化知,反应物是四氧化二氮、生成物是二氧化氮,根据v=
| △c |
| △t |
| c(N2O4) |
| c2(NO2) |
②反应进行至25min时,反应物和生成物浓度都减少,说明容器体积增大;
③化学平衡常数只与温度有关.
解答:
解:(1)根据图象知,硝酸的密度越大,生成二氧化氮的量越多,生成NO的量先增大后减小,当硝酸的密度为1.35g?mL-1时,生成的二氧化氮和一氧化氮的量相等,所以铁与密度为1.35g?mL-1的硝酸反应生成硝酸铁、二氧化氮和一氧化氮、水,反应方程式为:4Fe+18HNO3=4Fe(NO3)3+3NO↑+3NO2↑+9H2O,故答案为:4Fe+18HNO3=4Fe(NO3)3+3NO↑+3NO2↑+9H2O;
(2)酸性条件下,亚硝酸和碘化钾反应生成碘和NO、硝酸钾,离子方程式为6H++5NO2-+2I-=I2+NO3-+4NO↑+3H2O,氧化剂是亚硝酸根离子、还原剂是碘离子和亚硝酸根离子,氧化剂和还原剂的物质的量之比是4:3,故答案为:4:3;
(3)NO2和C0反应生成CO2和NO且放出热量,热化学反应方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=(134-368)kJ/mol=-234kJ/mol,故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol;
(4)①根据图象中物质浓度变化知,反应物是四氧化二氮、生成物是二氧化氮,v(NO2)=
=
=0.04mol/(L.min),平衡时c(NO2)=0.8mol/L,c(N2O4)=0.6mol/L,平衡常数K=
=
=0.9375,故答案为:0.04;0.9375;
②反应进行至25min时,反应物和生成物浓度都减少,说明容器体积增大,故答案为:增大容器体积;
③化学平衡常数只与温度有关,所以要改变平衡常数自由改变温度,故选C.
(2)酸性条件下,亚硝酸和碘化钾反应生成碘和NO、硝酸钾,离子方程式为6H++5NO2-+2I-=I2+NO3-+4NO↑+3H2O,氧化剂是亚硝酸根离子、还原剂是碘离子和亚硝酸根离子,氧化剂和还原剂的物质的量之比是4:3,故答案为:4:3;
(3)NO2和C0反应生成CO2和NO且放出热量,热化学反应方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=(134-368)kJ/mol=-234kJ/mol,故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol;
(4)①根据图象中物质浓度变化知,反应物是四氧化二氮、生成物是二氧化氮,v(NO2)=
| △c |
| △t |
| (0.8-0.4)mol/L |
| 10min |
| c(N2O4) |
| c2(NO2) |
| 0.6 |
| 0.8×0.8 |
②反应进行至25min时,反应物和生成物浓度都减少,说明容器体积增大,故答案为:增大容器体积;
③化学平衡常数只与温度有关,所以要改变平衡常数自由改变温度,故选C.
点评:本题考查了化学平衡的有关计算、氧化还原反应等知识点,根据物质的氧化性确定反应产物,从而写出方程式,会根据化学平衡常数进行有关计算,注意(4)中反应方向的判断,根据浓度变化量确定反应方向,为易错点.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
工业上用金红石(主要成分TiO2)制金属钛可通过以下反应进行:
①TiO2+2C+2Cl2
TiCl4+2CO ②TiCl4+2Mg
Ti+2MgCl2
对于上述两个反应的叙述正确的是( )
①TiO2+2C+2Cl2
| ||
| ||
| 加热 |
对于上述两个反应的叙述正确的是( )
| A、都是置换反应 |
| B、都是氧化还原反应 |
| C、反应中钛元素都被还原 |
| D、加热时金属钛和氩气(Ar)能反应 |
香叶醛分子的结构简式如图所示.下列叙述正确的是( )
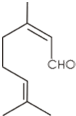

| A、1 mol香叶醛发生加成反应需要2 mol H2 |
| B、香叶醛不能与溴发生反应 |
| C、香叶醛能与钠发生反应生成H2 |
| D、香叶醛能发生银镜反应 |
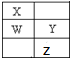 W、X、Y、Z为短周期元素,在周期表中的位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )
W、X、Y、Z为短周期元素,在周期表中的位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )| A、常压下四种元素的单质中,X的非金属性最强 |
| B、四种元素都能与氧元素形成稳定的化合物 |
| C、Y、Z 离子最外层电子数相同 |
| D、Y元素具有两性元素 |

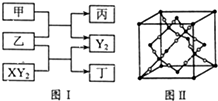 W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题:
W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题: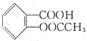 )在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:
)在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因: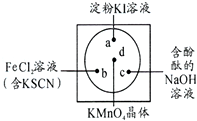 微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.
微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.