题目内容
H2SO3水溶液中存在电离平衡H2SO3?H++HSO3-和HSO3-?H++SO32-,若向H2SO3溶液中( )
| A、通入氯气,溶液中氢离子浓度增大 |
| B、通入过量H2S,反应后溶液pH减小 |
| C、加入氢氧化钠溶液,平衡向右移动,pH变小 |
| D、加入氯化钡溶液,平衡向右移动,会产生亚硫酸钡沉淀 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.氯气和亚硫酸发生氧化还原反应,离子反应方程式为:Cl2+H2SO3+H2O=4H++SO42-+2Cl-;
B.亚硫酸和硫化氢发生氧化还原反应方程式为:H2SO3+2H2S=3S↓+3H2O;
C.氢氧根离子和氢离子发生反应,离子方程式为OH-+H+=H2O;
D.盐酸酸性大于亚硫酸,氯化钡和亚硫酸不反应.
B.亚硫酸和硫化氢发生氧化还原反应方程式为:H2SO3+2H2S=3S↓+3H2O;
C.氢氧根离子和氢离子发生反应,离子方程式为OH-+H+=H2O;
D.盐酸酸性大于亚硫酸,氯化钡和亚硫酸不反应.
解答:
解:A.氯气和亚硫酸发生氧化还原反应,离子反应方程式为Cl2+H2SO3+H2O=4H++SO42-+2Cl-,溶液中氢离子浓度增大,故A正确;
B.亚硫酸和硫化氢发生氧化还原反应方程式为:H2SO3+2H2S=3S↓+3H2O,通入硫化氢后抑制亚硫酸电离,导致溶液中氢离子浓度减小,溶液的pH增大,故B错误;
C.氢氧根离子和氢离子发生反应,离子方程式为OH-+H+=H2O,平衡向正反应方向移动,但溶液中氢离子浓度减小,溶液的pH增大,故C错误;
D.盐酸酸性大于亚硫酸,氯化钡和亚硫酸不反应,氯化钡是强酸强碱盐,不水解,所以不影响亚硫酸电离,且不会产生亚硫酸钡沉淀,故D错误;
故选A.
B.亚硫酸和硫化氢发生氧化还原反应方程式为:H2SO3+2H2S=3S↓+3H2O,通入硫化氢后抑制亚硫酸电离,导致溶液中氢离子浓度减小,溶液的pH增大,故B错误;
C.氢氧根离子和氢离子发生反应,离子方程式为OH-+H+=H2O,平衡向正反应方向移动,但溶液中氢离子浓度减小,溶液的pH增大,故C错误;
D.盐酸酸性大于亚硫酸,氯化钡和亚硫酸不反应,氯化钡是强酸强碱盐,不水解,所以不影响亚硫酸电离,且不会产生亚硫酸钡沉淀,故D错误;
故选A.
点评:本题考查了弱电解质的电离,明确物质之间发生的反应是解本题关键,根据反应生成物及其性质确定溶液pH变化,题目难度不大.

练习册系列答案
相关题目
 如图是元素周期表短周期的一部分,A、C两种元素的核外电子数之和等于B的核外电子数.下列叙述正确的是( )
如图是元素周期表短周期的一部分,A、C两种元素的核外电子数之和等于B的核外电子数.下列叙述正确的是( )| A、A元素位于第二周期、ⅥA族 |
| B、原子半径C>B>A |
| C、在一定条件下,A、B的气态氢化物都能够与氧气反应 |
| D、三种元素都存在最高价含氧酸,且都显强酸性 |
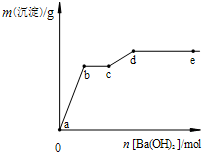 在含有4mol HCl和1mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法正确的是( )
在含有4mol HCl和1mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法正确的是( )| A、a→b时的沉淀的成分为BaSO4与Mg(OH)2 |
| B、b→c时发生的离子反应为:H++OH-→H2O |
| C、c→d时离子的物质的量:Ba2+可能大于Cl- |
| D、d→e时离子的物质的量:Ba2+一定大于OH- |
叠氮化钠(NaN3)是无色离子晶体,遇高热或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一.下列有关说法正确的是( )
| A、NaN3中只含有离子键 |
| B、1mol NaN3完全分解最多可以产生33.6L N2 |
| C、当有4.2g N2生成时,转移电子数约为6.02×1022 |
| D、常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项 |
 ( )
( )| A、置换反应 | B、水解反应 |
| C、中和反应 | D、电离过程 |
工业上用金红石(主要成分TiO2)制金属钛可通过以下反应进行:
①TiO2+2C+2Cl2
TiCl4+2CO ②TiCl4+2Mg
Ti+2MgCl2
对于上述两个反应的叙述正确的是( )
①TiO2+2C+2Cl2
| ||
| ||
| 加热 |
对于上述两个反应的叙述正确的是( )
| A、都是置换反应 |
| B、都是氧化还原反应 |
| C、反应中钛元素都被还原 |
| D、加热时金属钛和氩气(Ar)能反应 |
下列说法正确的是( )
| A、电子层数越多,原子半径一定越大 | ||||
B、已知2C+SiO2
| ||||
| C、第ⅥA族元素的氢化物中,稳定性最强的其沸点最低 | ||||
| D、按照元素周期表的排布规律,非金属元素最多为23种 |
在合成氨工业中,实现下列目的变化过程中与平衡移动无关的是( )
| A、为增加NH3的日产量,不断将NH3分离出来 |
| B、为增加NH3的日产量,使用催化剂 |
| C、为增加NH3的日产量,采用500℃左右的高温 |
| D、为增加NH3的日产量,采用2×107-5×107Pa的压强 |
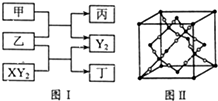 W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题:
W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题: