题目内容
对于同一周期从左到右的主族元素,下列说法中正确的是( )
| A、原子半径逐渐减小 |
| B、元素的金属性逐渐增强 |
| C、最高正化合价逐渐增大 |
| D、单质的熔沸点逐渐降低 |
考点:同一周期内元素性质的递变规律与原子结构的关系
专题:元素周期律与元素周期表专题
分析:同一周期从左到右的主族元素,原子半径在减小、非金属性增强、金属性减弱、最外层电子数增多,单质的熔沸点可能增大也可能减小,以此来解答.
解答:
解:A.同周期,从左到右原子半径逐渐减小,故A正确;
B.同周期,从左到右金属性减弱,故B错误;
C.同周期,从左到右最高正价逐渐增大,但第二周期O、F没有正价,故C错误;
D.同周期,从左到右熔沸点没有明显变化规律,如第三周期中Na的熔点小于Si,Si的熔点大于S等,故D错误;
故选A.
B.同周期,从左到右金属性减弱,故B错误;
C.同周期,从左到右最高正价逐渐增大,但第二周期O、F没有正价,故C错误;
D.同周期,从左到右熔沸点没有明显变化规律,如第三周期中Na的熔点小于Si,Si的熔点大于S等,故D错误;
故选A.
点评:本题考查同周期元素性质的变化规律,为高频考点,把握元素周期律为解答的关键,注意选项D为解答的易错点,明确O、F没有正价即可解答,题目难度不大.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
叠氮化钠(NaN3)是无色离子晶体,遇高热或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一.下列有关说法正确的是( )
| A、NaN3中只含有离子键 |
| B、1mol NaN3完全分解最多可以产生33.6L N2 |
| C、当有4.2g N2生成时,转移电子数约为6.02×1022 |
| D、常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项 |
在合成氨工业中,实现下列目的变化过程中与平衡移动无关的是( )
| A、为增加NH3的日产量,不断将NH3分离出来 |
| B、为增加NH3的日产量,使用催化剂 |
| C、为增加NH3的日产量,采用500℃左右的高温 |
| D、为增加NH3的日产量,采用2×107-5×107Pa的压强 |
香叶醛分子的结构简式如图所示.下列叙述正确的是( )
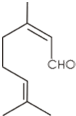

| A、1 mol香叶醛发生加成反应需要2 mol H2 |
| B、香叶醛不能与溴发生反应 |
| C、香叶醛能与钠发生反应生成H2 |
| D、香叶醛能发生银镜反应 |
在2A(g)+5B(g)?2C(g)+3D(g)反应中,下列反应速率最快的是( )
| A、υ(A)=0.8 mol/(L?s) |
| B、υ(B)=1.0 mol/(L?s) |
| C、υ(C)=1.8 mol/(L?min) |
| D、υ(D)=0.9 mol/(L?s) |
下列离子方程式正确的是( )
| A、1mol Cl2通入含有2mol FeI2的溶液中:2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 |
| B、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| C、AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| D、向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH-+3H+═Ag++2NH4++H2O |

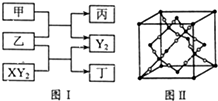 W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题:
W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题: