题目内容
含铬的废水具有毒性,必须进行处理才能排放.为实现变废为宝,可将废水经过下列处理得磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2价),实验流程如下:
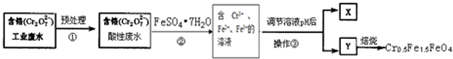
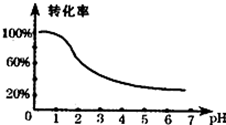
已知废水的酸碱性会影响到Cr2O72-与Cr3+之间的相互转化,转化关系如图所示.
(1)预处理①中的关键是 ;
(2)实验室中操作③所用的玻璃仪器名称是 ;
(3)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式: ;
(4)物质Y中除了有Cr(OH)3外,还有 (填化学式)
(5)已知Cr2O72-有较强的氧化性,一定条件下可将I-氧化为I2,自身还原为Cr3+,依此原理实验室可通过以下方法测定废水中Cr2O72-的浓度:取含Cr2O72-废水2L蒸发浓缩至100ml,然后用酸性滴定管准确量取10.00mL于锥形瓶中,加入5mL 2mol/L H2SO4溶液和足量碘化钾,再加入2mL淀粉指示剂,用0.1000mol/L
Na2S2O3标准溶液滴定(I2+2S2O32-═2I-+S4O62-)
①判断达到滴定终点的现象是 ;
②若实验中共用去Na2S2O3标准溶液12.00mL,则废水中Cr2O72-的浓度 ;
③欲使1L该废水中的Cr2O72-完全转化为Cr05Fe15FeO,理论上在操作②中需要加入 g FeSO4?7H2O.

已知废水的酸碱性会影响到Cr2O72-与Cr3+之间的相互转化,转化关系如图所示.

(1)预处理①中的关键是
(2)实验室中操作③所用的玻璃仪器名称是
(3)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式:
(4)物质Y中除了有Cr(OH)3外,还有
(5)已知Cr2O72-有较强的氧化性,一定条件下可将I-氧化为I2,自身还原为Cr3+,依此原理实验室可通过以下方法测定废水中Cr2O72-的浓度:取含Cr2O72-废水2L蒸发浓缩至100ml,然后用酸性滴定管准确量取10.00mL于锥形瓶中,加入5mL 2mol/L H2SO4溶液和足量碘化钾,再加入2mL淀粉指示剂,用0.1000mol/L
Na2S2O3标准溶液滴定(I2+2S2O32-═2I-+S4O62-)
①判断达到滴定终点的现象是
②若实验中共用去Na2S2O3标准溶液12.00mL,则废水中Cr2O72-的浓度
③欲使1L该废水中的Cr2O72-完全转化为Cr05Fe15FeO,理论上在操作②中需要加入
考点:物质分离和提纯的方法和基本操作综合应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:实验设计题
分析:根据题目信息可知:由Cr2O72-与Cr3+之间的相互转化关系图可知:当pH<1时,Cr2O72-转化为Cr3+的转化率接近100%,所以进行溶液酸碱性预处理,Cr2O72-有较强氧化性,FeSO4?7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,由于Fe2+过量,此时溶液中含有Fe2+、Fe3+、Cr3+,调节PH,碱性条件下Fe2+、Fe3+不能存在,产生Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀物,第③步过滤得到的滤渣中主要成分除Cr(OH)3外,还有Fe(OH)2、Fe(OH)3,灼烧得到磁性材料Cr0.5Fe1.5FeO4.
(1)根据废水pH与Cr2O72-转化为Cr3+的关系图分析;
(2)操作③为过滤,根据过滤确定所需仪器;
(3)Cr2O72-有较强氧化性,FeSO4?7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第二步反应中Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据守恒元素守恒及所处环境可知,还应有水生成.再根据电子转移守恒、电荷守恒、原子守恒配平;
(4)由题给框图之三可得:Fe2+过量,加NaOH时,产生Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀物;(5)①碘单质与淀粉作用显蓝色,碘能与亚硫酸钠发生氧化还原反应;
②根据Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-,可得:Cr2O72-~3I2~6S2O32-关系式,依此进行计算;
③根据Cr原子计算Cr0.5Fe1.5FeO4的物质的量,结合Cr0.5Fe1.5FeO4的物质的量利用Fe原子守恒计算FeSO4?7H2O质量.
(1)根据废水pH与Cr2O72-转化为Cr3+的关系图分析;
(2)操作③为过滤,根据过滤确定所需仪器;
(3)Cr2O72-有较强氧化性,FeSO4?7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第二步反应中Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据守恒元素守恒及所处环境可知,还应有水生成.再根据电子转移守恒、电荷守恒、原子守恒配平;
(4)由题给框图之三可得:Fe2+过量,加NaOH时,产生Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀物;(5)①碘单质与淀粉作用显蓝色,碘能与亚硫酸钠发生氧化还原反应;
②根据Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-,可得:Cr2O72-~3I2~6S2O32-关系式,依此进行计算;
③根据Cr原子计算Cr0.5Fe1.5FeO4的物质的量,结合Cr0.5Fe1.5FeO4的物质的量利用Fe原子守恒计算FeSO4?7H2O质量.
解答:
解:由Cr2O72-与Cr3+之间的相互转化关系图可知:当pH<1时,Cr2O72-转化为Cr3+的转化率接近100%,所以进行预处理,Cr2O72-有较强氧化性,FeSO4?7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,碱性条件下Fe2+、Fe3+不能存在,会转化为Fe(OH)2、Fe(OH)3,所以调节PH,第③步过滤得到的滤渣中主要成分除Cr(OH)3外,还有Fe(OH)2、Fe(OH)3,灼烧得到磁性材料Cr0.5Fe1.5FeO4.
(1)根据废水pH与Cr2O72-转化为Cr3+的关系图1可知:当pH<1时,Cr2O72-转化为Cr3+的转化率接近100%,
故答案为:调节废液pH<1;
(2)操作③为过滤,需要的玻璃仪器为玻璃棒、漏斗、烧杯,
故答案为:玻璃棒、漏斗、烧杯;
(3)Cr2O72-有较强氧化性,FeSO4?7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第二步反应中Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据守恒元素守恒及所处环境可知,还应有水生成,反应离子方程式为Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O;
(4)由于Fe2+过量,溶液中含有Fe2+、Fe3+、Cr3+,调节PH,产生Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀物,焙烧得到Cr0.5Fel1.5FeO4,
故答案为:Fe(OH)3、Fe(OH)2;
(5)①溶液中有碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,碘单质反应完全,蓝色褪去,
故答案为:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②酸性条件下,I-被Cr2O72-氧化的产物为I2.Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,用0.1000mol/L
Na2S2O3标准溶液滴定I2+2S2O32-═2I-+S4O62-,根据反应的关系式计算:
Cr2O72-~3I2~6S2O32-
1mol 6mol
n 0.1000mol?L-1×0.012L
n=0.0002mol,则废水中Cr2O72-的浓度0.0002mol÷0.01L÷20=1.00×10-3mol/L,
故答案为:1.00×10-3mol/L;
(5)1L废水中含n(Cr2O72-)=1.00×10-3mol.根据Cr原子、Fe原子守恒,可得:Cr2O72-~4Cr0.5Fe1.5FeO4~10FeSO4?7H2O,所以理论上n(FeSO4?7H2O)=10n(Cr2O72-)=1.00×10-3 mol×10=0.01mol,所以m(FeSO4?7H2O)=0.01mol×278g/mol=2.78g,
故答案为:2.78.
(1)根据废水pH与Cr2O72-转化为Cr3+的关系图1可知:当pH<1时,Cr2O72-转化为Cr3+的转化率接近100%,
故答案为:调节废液pH<1;
(2)操作③为过滤,需要的玻璃仪器为玻璃棒、漏斗、烧杯,
故答案为:玻璃棒、漏斗、烧杯;
(3)Cr2O72-有较强氧化性,FeSO4?7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第二步反应中Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据守恒元素守恒及所处环境可知,还应有水生成,反应离子方程式为Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O;
(4)由于Fe2+过量,溶液中含有Fe2+、Fe3+、Cr3+,调节PH,产生Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀物,焙烧得到Cr0.5Fel1.5FeO4,
故答案为:Fe(OH)3、Fe(OH)2;
(5)①溶液中有碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,碘单质反应完全,蓝色褪去,
故答案为:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②酸性条件下,I-被Cr2O72-氧化的产物为I2.Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,用0.1000mol/L
Na2S2O3标准溶液滴定I2+2S2O32-═2I-+S4O62-,根据反应的关系式计算:
Cr2O72-~3I2~6S2O32-
1mol 6mol
n 0.1000mol?L-1×0.012L
n=0.0002mol,则废水中Cr2O72-的浓度0.0002mol÷0.01L÷20=1.00×10-3mol/L,
故答案为:1.00×10-3mol/L;
(5)1L废水中含n(Cr2O72-)=1.00×10-3mol.根据Cr原子、Fe原子守恒,可得:Cr2O72-~4Cr0.5Fe1.5FeO4~10FeSO4?7H2O,所以理论上n(FeSO4?7H2O)=10n(Cr2O72-)=1.00×10-3 mol×10=0.01mol,所以m(FeSO4?7H2O)=0.01mol×278g/mol=2.78g,
故答案为:2.78.
点评:本题以工业废水处理为载体,考查氧化还原反应、离子反应、关系式计算等,题目难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查.是一道不错的能力考查题.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案
相关题目
在合成氨工业中,实现下列目的变化过程中与平衡移动无关的是( )
| A、为增加NH3的日产量,不断将NH3分离出来 |
| B、为增加NH3的日产量,使用催化剂 |
| C、为增加NH3的日产量,采用500℃左右的高温 |
| D、为增加NH3的日产量,采用2×107-5×107Pa的压强 |
下列离子方程式正确的是( )
| A、1mol Cl2通入含有2mol FeI2的溶液中:2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 |
| B、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| C、AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| D、向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH-+3H+═Ag++2NH4++H2O |
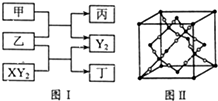 W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题:
W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题: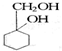 的流程图:
的流程图: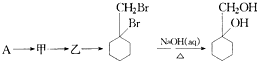
 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: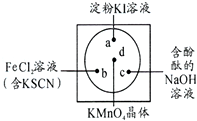 微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.
微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.