题目内容
2.实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色,易潮解,100℃左右时会升华.如图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置不同,分别如装置Ⅰ和装置II所示.已知B中反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑
(1)C中浓盐酸的作用是干燥氯气.
(2)D中的反应开始前,要先通入一段时间的氯气,其原因是排尽装置中的空气,以免生成的氯化铁不纯.
(3)D中反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3.
(4)装置Ⅰ的主要缺点是没有尾气中氯气的吸收装置.
(5)装置II的主要缺点是没有干燥装置,生成的氯化铁易潮解.
分析 (1)D中氯气与Fe反应生成氯化铁,而氯化铁易潮解,制备的氯气中含有水蒸气,需要进行干燥;
(2)装置中含有空气,D中加热时氧气能与Fe反应;
(3)D中氯气与Fe加热条件下反应生成氯化铁;
(4)氯气有毒,会污染空气,需要进行尾气处理;
(5)E中收集氯化铁,而氯化铁易潮解,F中水蒸气易进入E中使其潮解.
解答 解:(1)D中氯气与Fe反应生成氯化铁,而氯化铁易潮解,制备的氯气中含有水蒸气,需要进行干燥,则C中浓硫酸的作用是:干燥氯气,
故答案为:干燥氯气;
(2)装置中含有空气,D中加热时氧气能与Fe反应,反应开始前,要先通入一段时间的氯气,排尽装置中的空气,以免生成的氯化铁不纯,
故答案为:排尽装置中的空气,以免生成的氯化铁不纯;
(3)D中氯气与Fe加热条件下反应生成氯化铁,反应方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(4)氯气有毒,会污染空气,需要进行尾气处理,装置I没有尾气中氯气的吸收装置,
故答案为:没有尾气中氯气的吸收装置;
(5)E中收集氯化铁,而氯化铁易潮解,F中水蒸气易进入E中,装置Ⅱ没有干燥装置,生成的氯化铁易潮解,
故答案为:没有干燥装置,生成的氯化铁易潮解.
点评 本题考查物质制备实验,涉及氯气制备、对装置的分析评价、信息获取与迁移应用等,关键是明确实验原理,是对学生综合能力的考查,难度中等.

练习册系列答案
相关题目
13.已知2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol,Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO(g) 与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023 | |
| B. | 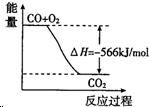 图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452kJ/mol | |
| D. | CO的燃烧热为283kJ |
10.在澄清透明的强酸性溶液中能大量共存的是( )
| A. | NH4+ Fe3+ SO42- NO3- | B. | K+ Na+ CO32- NO3- | ||
| C. | K+ NH4+ OH- SO42- | D. | Na+ K+ AlO2- Cl- |
17.下列溶液中有关物质的量浓度关系正确的是( )
| A. | 碳酸氢钠溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COO Na 溶液等体积混合:c(CH3COOH)+c(CH3COO-)=2 c(Na+) | |
| C. | 硫酸铜溶液与过量浓氨水反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2 NH4+ | |
| D. | 一定浓度的盐酸和氨水混合可能出现c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
14.下列说法或表述中正确的是( )
| A. | 烷烃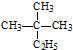 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 由石油分馏可以获得石蜡,由石蜡裂化可获得乙烯 | |
| C. | 图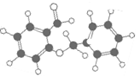 所示的有机物分子式为C14H12O2,能发生银镜反应 所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在稀硫酸溶液中,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
11.符合如图能量变化的反应是 ( )


| A. | H+H→H-H | B. | H-C1→H+C1 | ||
| C. | Mg+2HCl═MgCl2+H2↑ | D. | H2SO4+2NaOH═Na2SO4+2H2O |
12.下列说法正确的是( )
| A. | 升高温度能使化学反应速率增大,主要原因是降低了反应活化能 | |
| B. | 有气体参加的化学反应,增大压强一定可以增大化学反应速率 | |
| C. | 增大反应物浓度,可提高单位体积内活化分子的百分数,从而使有效碰撞次数增大 | |
| D. | 催化剂的加入能提高单位体积内活化分子百分数,从而增大化学反应速率 |
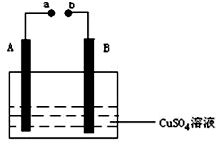 如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则: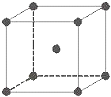 金属铁晶体为体心立方堆积(如图),实验测得铁的密度为ρ(g•cm-3).已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1).
金属铁晶体为体心立方堆积(如图),实验测得铁的密度为ρ(g•cm-3).已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1).