题目内容
7.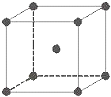 金属铁晶体为体心立方堆积(如图),实验测得铁的密度为ρ(g•cm-3).已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1).
金属铁晶体为体心立方堆积(如图),实验测得铁的密度为ρ(g•cm-3).已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1).(1)则铁原子的半径r(cm)为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2a}{ρ{N}_{A}}}$.(用字母符号式子表示)
(2)该晶体中的原子空间利用率为68%.
(3)铁元素的原子序数是26,其基态原子的电子排布式为1s22s22p63s23p63d64s2,其同周期第ⅠA族元素基态原子的第一电离能比同周期其它基态原子的第一电离能(稀有气体原子除外)小.
(4)铁晶体中铁原子的配位数为8.
(5)下列关于晶体的说法中,不正确的是①②⑦.
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列
⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定
⑦干冰晶体中,一个CO2分子周围有12个CO2分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6
⑧二氧化硅晶体结构单元中硅原子采用的是sp3杂化存在正四面体.
分析 (1)铁原子的半径为rcm,则晶胞体积对角线长度为4r cm,可知晶胞棱长为$\frac{4\sqrt{3}}{3}$r cm,利用均摊法计算晶胞中Fe原子数目,表示出晶胞质量,再根据m=ρV列式计算;
(2)空间利用率=$\frac{晶胞中Fe原子总体积}{晶胞体积}$×100%;
(3)铁元素的原子序数是26,根据能量最低原理书写其基态原子的电子排布式,金属性越强,第一电离能越小;
(4)金属Fe为体心立方密堆积,Fe原子配位数为8;
(5)①物质并不都是由原子构成的;
②金属晶体的构成微粒为金属阳离子与自由电子;
③原子晶体中共价键可决定分子晶体的熔、沸点;
④离子所带电荷越多、离子半径越小,晶格能越大;
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列;
⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定;
⑦CsCl晶体中阴、阳离子的配位数都为8;
⑧二氧化硅晶体结构单元为硅氧正四面体,Si原子形成4个Si-O键中硅原子.
解答 解:(1)铁原子的半径为rcm,则晶胞体积对角线长度为4r cm,可知晶胞棱长为$\frac{4\sqrt{3}}{3}$r cm,晶胞中Fe原子数目为1+8×$\frac{1}{8}$=2,铁的相对原子质量为a,晶胞质量为2×$\frac{a}{{N}_{A}}$g,铁的密度为ρ(g•cm-3),则:ρ(g•cm-3)×($\frac{4\sqrt{3}}{3}$r cm)3=2×$\frac{a}{{N}_{A}}$g,故r=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2a}{ρ{N}_{A}}}$,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2a}{ρ{N}_{A}}}$;
(2)晶胞中Fe原子总体积为2×$\frac{4}{3}$π(rcm)3,晶胞体积为($\frac{4\sqrt{3}}{3}$r cm)3,则空间利用率=$\frac{2×\frac{4}{3}π{r}^{3}}{(\frac{4\sqrt{3}}{3}r)^{3}}$×100%=68%,
故答案为:68%;
(3)铁元素的原子序数是26,基态原子的电子排布式为1s22s22p63s23p63d64s2,其同周期第ⅠA族元素基态原子的第一电离能比同周期其它基态原子的第一电离能(稀有气体原子除外)小,
故答案为:1s22s22p63s23p63d64s2;小;
(4)金属Fe为体心立方密堆积,体心Fe原子与顶点8个Fe原子相邻.Fe原子配位数为8,
故答案为:8;
(5)①构成物质的微粒中,晶体中微粒呈周期性有序排列,有自范性,非晶体中微粒排列相对无序,无自范性,但物质不能都是由原子构成的,故错误;
②金属晶体的构成微粒为金属阳离子与自由电子,含有金属阳离子的晶体不一定是离子晶体,故错误;
③原子晶体中共价键可决定分子晶体的熔、沸点,故正确;
④离子所带电荷越多、离子半径越小,晶格能越大,MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小,故正确;
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列,故正确;
⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定,故正确;
⑦干冰晶体中,一个CO2分子周围有12个CO2分子紧邻,NaCl晶体中阴、阳离子的配位数都为6,但CsCl晶体中阴、阳离子的配位数都为8,故错误;
⑧二氧化硅晶体结构单元为硅氧正四面体,Si原子形成4个Si-O键中硅原子,硅原子采用的是sp3杂化,故正确,
故选:①②⑦.
点评 本题是对物质结构与性质的考查,涉及晶胞结构与计算、核外电子排布、晶体与非晶体、晶体类型与性质等,理解掌握均摊法进行晶胞有关计算,识记中学常见晶胞结构.

| A. | 青石棉是一种易燃品且易溶于水 | |
| B. | 青石棉的化学组成用氧化物的形式可表示为:Na2O•FeO•2Fe2O3•8SiO2•H2O | |
| C. | 1 mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗6 L 3 mol•L-1 HNO3溶液 | |
| D. | 1 mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗5.5 L 2 mol•L-1HF溶液 |
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)═c(NO3-) | |
| B. | 0.1mol/L某二元弱酸强碱盐NaHA溶液中:c(Na+)═2c(A2-)+c(HA-)+c(H2A) | |
| C. | 10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 常温下,0.1mol/L pH=4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
| A. |  太阳能生热器 | B. |  硅太阳能电池 | C. |  燃气灶 | D. |  锂离子电池 |
| A. | 都具有脱水性 | |
| B. | 在加热条件下都能与碳反应 | |
| C. | 露置于空气中都能形成白雾 | |
| D. | 在空气中长期露置,溶液质量均减轻 |

