题目内容
12.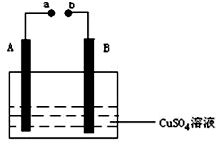 如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:(1)b为电源的负极(填“正”、“负”)
(2)写出电解池中的总反应方程式:2Cu2++2H2O=2Cu+O2+4H+.
分析 (1)B电极质量增加依据电解池原理分析判断,B为电解池的阴极,A为阳极,a为电源正极,b为电源负极;
(2)电解过程中阳极水电离的氢氧根离子失去电子生成氧气,阴极电极反应为Cu2++2e-=Cu,据此写出电极总反应方程式.
解答 解:B电极质量增加依据电解池原理分析判断,B为电解池的阴极,A为阳极,a为电源正极,b为电源负极;电解过程中阳极电极反应4OH--4e-=2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu,
(1)根据分析可知,a电极是电源的正极,b为电源负极,
故答案为:负;
(2)依据分析可知A为阳极,溶液中水电离的氢氧根离子失电子生成氧气,B为阴极,溶液中铜离子得到电子生成铜,电极反应为Cu2++2e-=Cu,则电极总反应方程式为:2Cu2++2H2O=2Cu+O2+4H+,
故答案为:2Cu2++2H2O=2Cu+O2+4H+.
点评 本题考查了电解池原理及其应用,题目难度不大,明确电极判断和电极反应的书写方法是解题关键,注意熟练掌握电解池工作原理,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
3.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol•L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是玻璃棒、100mL容量瓶.
(2)下列有关配制过程中说法错误的是abde(填序号).
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色.某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+.
(3)请你完成下表,验证假设
若假设1正确,从实验①分离出Br2的实验操作名称是萃取和分液
(4)若在50mL上述FeBr2溶液通入标准状况下112mL Cl2,反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
I.实验需要90mL 0.10mol•L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是玻璃棒、100mL容量瓶.
(2)下列有关配制过程中说法错误的是abde(填序号).
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色.某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+.
(3)请你完成下表,验证假设
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入四氯化碳,操作振荡、静置, 现象CCl4层呈橙红色,水层呈无色 | 假设1正确 |
| ②向溶液中另入KSCN溶液, 现象溶液变为红色 | 假设2正确 |
(4)若在50mL上述FeBr2溶液通入标准状况下112mL Cl2,反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
20.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
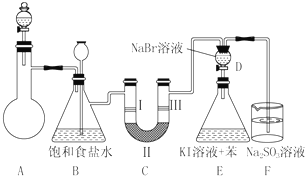
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关反应的化学方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是d(填编号).
装置B是安全瓶,监测实验进行时C中是否发生堵塞,写出发生堵塞时B中的现象锥形瓶中液面下降,长颈漏斗中液面上升.
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.该现象不能(填“能”或“不能”)说明Br2的氧化性强于I2.
(4)有人提出,装置F中可改用过量的NaHSO3溶液吸收余氯,试写出相应反应的离子方程式4HSO3-+Cl2=SO42-+2Cl-+3SO2↑+2H2O;你认为不能(填“能”或“不能”)改用NaHSO3溶液.

(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关反应的化学方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是d(填编号).
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.该现象不能(填“能”或“不能”)说明Br2的氧化性强于I2.
(4)有人提出,装置F中可改用过量的NaHSO3溶液吸收余氯,试写出相应反应的离子方程式4HSO3-+Cl2=SO42-+2Cl-+3SO2↑+2H2O;你认为不能(填“能”或“不能”)改用NaHSO3溶液.
7.用浓硫酸配制一定物质的量浓度稀硫酸时,下列操作使溶质物质的量浓度偏高的是( )
| A. | 用敞开放置久了的浓硫酸进行配制 | B. | 量取浓硫酸仰视刻度线 | ||
| C. | 配制过程中未洗涤烧杯和玻璃棒 | D. | 配制前,容量瓶有少许蒸馏水 |
17.青石棉(cricidolite)是世界卫生组织确认的一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一.青石棉的化学式为:Na2Fe5Si8O22(OH)2.青石棉用稀硝酸处理时,还原产物只有NO.下列说法中正确的是( )
| A. | 青石棉是一种易燃品且易溶于水 | |
| B. | 青石棉的化学组成用氧化物的形式可表示为:Na2O•FeO•2Fe2O3•8SiO2•H2O | |
| C. | 1 mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗6 L 3 mol•L-1 HNO3溶液 | |
| D. | 1 mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗5.5 L 2 mol•L-1HF溶液 |
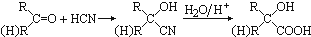 ,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成:
,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成: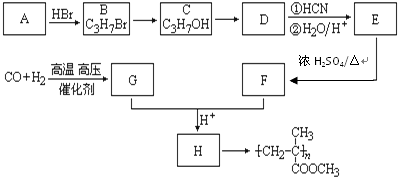
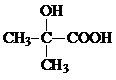 ;
; ;
;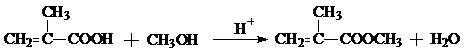 ;
;