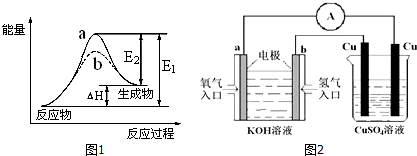
题目内容
11.符合如图能量变化的反应是 ( )
| A. | H+H→H-H | B. | H-C1→H+C1 | ||
| C. | Mg+2HCl═MgCl2+H2↑ | D. | H2SO4+2NaOH═Na2SO4+2H2O |
分析 生成物具有的总能量高于反应物具有的总能量,该反应为吸热反应,据此分析.
解答 解:A.原子结合为分子,形成化学键的过程为放热反应,故A错误;
B.分子转化为原子,化学键断裂为吸热过程,故B正确;
C.金属单质与酸的反应是放热反应,故C错误;
D.酸碱中和反应是放热反应,故D错误.
故选B.
点评 本题考查化学反应中能量变化图,题目难度不大,学生应注重归纳中学化学中常见的吸热或放热的反应,侧重于考查学生的分析能力.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
19.下列溶液中,有关物质的量浓度关系正确的是( )
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)═c(NO3-) | |
| B. | 0.1mol/L某二元弱酸强碱盐NaHA溶液中:c(Na+)═2c(A2-)+c(HA-)+c(H2A) | |
| C. | 10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 常温下,0.1mol/L pH=4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
16.下列设备工作时,将化学能转化为热能的是( )
| A. |  太阳能生热器 | B. |  硅太阳能电池 | C. |  燃气灶 | D. |  锂离子电池 |
20.欲将 转化为
转化为 ,可以加入( )
,可以加入( )
 转化为
转化为 ,可以加入( )
,可以加入( )| A. | 水 | B. | 碳酸氢钠溶液 | C. | 碳酸 | D. | 盐酸 |
1.下列与化学有关的说法不正确的是( )
| A. | 洁厕灵的主要成分是盐酸,不能与“84”消毒液(主要成分是NaClO)混用 | |
| B. | 晶体的风化、煤的液化、石油的裂化都是化学变化 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |

 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答:
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答: