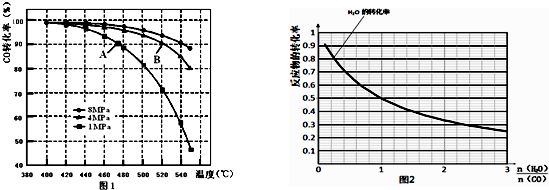
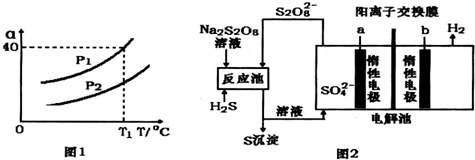
题目内容
10.向饱和BaSO4溶液中加水,下列叙述中正确的是( )| A. | BaSO4的溶解度增大,Ksp不变 | B. | BaSO4的溶解度、Ksp均增大 | ||
| C. | BaSO4的溶解度、Ksp均不变 | D. | BaSO4的溶解度不变,Ksp增大 |
分析 温度不变时,向饱和BaSO4溶液中加水,硫酸钡的溶解度不变,沉淀溶解平衡的溶度积不变.
解答 解:物质的溶解度是一定温度下的物理量,温度、溶剂不变,则物质溶解度不变,
沉淀溶解平衡状态下的溶度积常数,随温度变化,不随浓度变化,一定温度下存在:Ksp=c(Ba2+)c(SO42-),温度不变,则Ksp不变;
故选C.
点评 本题考查了物质溶解度、沉淀溶解平衡存在的溶度积常数的影响因素分析,掌握基础是解题关键.

练习册系列答案
相关题目
8.下列说法中正确的是( )
| A. | 1mol任何气体的体积都约是22.4L | |
| B. | lmolH2和O2的混合气体,在标准状况下的体积约为22.4L | |
| C. | lmol H2气态物质,当体积为22.4L时,该气体一定处于标准状况 | |
| D. | 标准状况下,2molH2O体积约为44.8L |
15.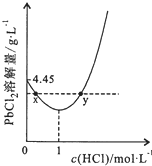 20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
 20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )| A. | 盐酸浓度越大,Ksp(PbCl2)越大 | |
| B. | PbCl2能与一定浓度的盐酸反应 | |
| C. | x、y两点对应的溶液中c(Pb2+)相等 | |
| D. | 往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s) |
19.甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料.
(1)煤制天然气时会发生多个反应,生产过程中有多种途径生成CH4.
已知:C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-203kJ•mol-1
写出CO与H2O(g)反应生成H2和CO2的热化学方程式CO(g)+H2O(g)=H2(g)+CO2(g),△H=-41kJ/mol.
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,
已知T℃,k(NH3•H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是ac.
a.[NH4+]>[HS-]>[OH-]>[H+]b.[HS-]>[NH4+]>[S2-]>[H+]
c.[NH4+]>[HS-]>[H2S]>[H+]d.[HS-]>[S2-]>[H+]>[OH-]
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)═CO(g)+3H2(g).
①该反应的逆反应速率表达式为:v=kc(CO)c3(H2),k为速率常数,在某温度下,测得实验数据如表:
由上述数据可得该温度下,上述反应的逆反应速率常数k为1.2×104 L3•mol-3•min-1.
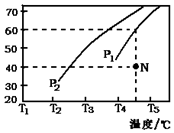
②在体积为2L的密闭容器中通入物质的量均为2mol的CH4和水蒸气,在一定条件下发生反应,测得H2的体积分数与温度及压强的关系如图2所示,则压强P1大于P2(填“大于”或“小于”);温度T3小于T4(填“大于”或“小于”);
③压强为P1时,在N点:v正大于v逆(填“大于”、“小于”或“等于”). 求N点对应温度下该反应的平衡常数K=48.
(1)煤制天然气时会发生多个反应,生产过程中有多种途径生成CH4.
已知:C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-203kJ•mol-1
写出CO与H2O(g)反应生成H2和CO2的热化学方程式CO(g)+H2O(g)=H2(g)+CO2(g),△H=-41kJ/mol.
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,
已知T℃,k(NH3•H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是ac.
a.[NH4+]>[HS-]>[OH-]>[H+]b.[HS-]>[NH4+]>[S2-]>[H+]
c.[NH4+]>[HS-]>[H2S]>[H+]d.[HS-]>[S2-]>[H+]>[OH-]
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)═CO(g)+3H2(g).
①该反应的逆反应速率表达式为:v=kc(CO)c3(H2),k为速率常数,在某温度下,测得实验数据如表:
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.1 | c1 | 9.6 |
| c2 | c1 | 19.2 |
| c2 | 0.3 | 64.8 |
②在体积为2L的密闭容器中通入物质的量均为2mol的CH4和水蒸气,在一定条件下发生反应,测得H2的体积分数与温度及压强的关系如图2所示,则压强P1大于P2(填“大于”或“小于”);温度T3小于T4(填“大于”或“小于”);
③压强为P1时,在N点:v正大于v逆(填“大于”、“小于”或“等于”). 求N点对应温度下该反应的平衡常数K=48.

20.25°C时,某化学实验小组同学向用大理石和稀盐酸制备CO2后的残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示.下列说法不正确的是( )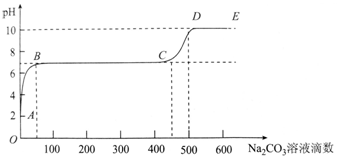

| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) | |
| D. | AB发生的反应为:Ca2++CO32-═CaCO3↓ |
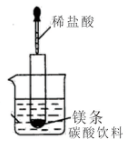 (1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.
(1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.