题目内容
20.25°C时,某化学实验小组同学向用大理石和稀盐酸制备CO2后的残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示.下列说法不正确的是( )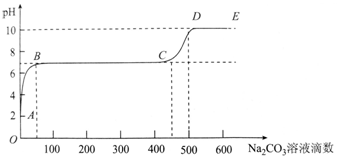
| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) | |
| D. | AB发生的反应为:Ca2++CO32-═CaCO3↓ |
分析 根据图象可知,用大理石和稀盐酸制备CO2后的残留液pH=2,溶液显酸性,则说明盐酸剩余,即A点溶液中含CaCl2和过量的盐酸;
向残留液中加入碳酸钠溶液,则Na2CO3和HCl反应:Na2CO3+2HCl=2NaCl+CO2+H2O,导致溶液的pH升高,即AB段;
在B点时,溶液的pH=7,则此时Na2CO3将盐酸恰好完全反应,即B点溶液中的溶质只有NaCl和CaCl2;
继续滴加碳酸钠溶液,则Na2CO3和CaCl2反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,即BC段,溶液的pH不变;
在C点时,溶液中的CaCl2完全反应,继续滴加碳酸钠溶液,碳酸钠过量,由于碳酸钠为强碱弱酸盐,水解显碱性,故溶液的pH生高,即CD段,据此进行分析.
解答 解:根据图象可知,用大理石和稀盐酸制备CO2后的残留液pH=2,溶液显酸性,则说明盐酸剩余,即A点溶液中含CaCl2和过量的盐酸;
向残留液中加入碳酸钠溶液,则Na2CO3和HCl反应:Na2CO3+2HCl=2NaCl+CO2+H2O,导致溶液的pH升高,即AB段;
在B点时,溶液的pH=7,则此时Na2CO3将盐酸恰好完全反应,即B点溶液中的溶质只有NaCl和CaCl2;
继续滴加碳酸钠溶液,则Na2CO3和CaCl2反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,即BC段,溶液的pH不变;
在C点时,溶液中的CaCl2完全反应,继续滴加碳酸钠溶液,碳酸钠过量,由于碳酸钠为强碱弱酸盐,水解显碱性,故溶液的pH生高,即CD段,
A.用大理石和稀盐酸制备CO2后的残留液pH=2,溶液显酸性,则说明盐酸剩余,故A正确;
B.BC段溶液的pH不变,是由于Na2CO3和CaCl2反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,离子方程式为:Ca2++CO32-═CaCO3↓,故碳酸钙沉淀的量增多,故B正确;
C.滴入500滴碳酸钠溶液后,溶液的pH大于7,则c(OH-)>c(H+),故C正确;
D.由于残留液中有盐酸剩余,故向残留液中加入碳酸钠溶液,AB段发生Na2CO3和HCl反应:Na2CO3+2HCl=2NaCl+CO2+H2O,离子方程式为:CO32-+2H+=CO2+H2O,故D错误;
故选D.
点评 本题考查了难溶物溶解平衡及沉淀转化的本质,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握难溶物溶解平衡及其影响因素,试题培养了学生的灵活应用能力.

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案| A. | BaSO4的溶解度增大,Ksp不变 | B. | BaSO4的溶解度、Ksp均增大 | ||
| C. | BaSO4的溶解度、Ksp均不变 | D. | BaSO4的溶解度不变,Ksp增大 |
(1)已知CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;则该反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.12kJ/mol;.
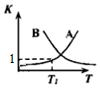
(2)该反应随温度升高正、逆反应平衡常数的变化曲线如图所示,表示K正的曲线为B(选填“A”或“B”),理由是正反应为放热反应,升高温度,平衡向逆向移动,K值减小.
(3)T1℃时,向容积固定为5L的容器中充入2mol水蒸气和3molCO,发生上述反应达平衡,则平衡时水蒸气的转化率是60%(填字母)
(4)保持温度为T1℃,改变水蒸气和CO的初始物质的量之比,充入恒容容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填字母)
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a molH2
d.混合气中 n(CO):n(H2O):n(CO2):n(H2)=9:4:6:6
(5)某工业合成氨的原料气组成为:H240%、N220%、CO30%、CO210% (均为体积分数).向上述原料气中加入水蒸气,以除去其中的CO.己知不同温度下的反应物投料比[$\frac{n({H}_{2}0)}{n(C0)}$],平衡时混合气体中CO的体积分数如表所示:
| CO体积分数% 投料比 | 温度/℃ | ||||
| 200 | T2 | T3 | T4 | ||
| $\frac{n({H}_{2}0)}{n(C0)}$ | 1 | 1.70 | 2.73 | 6.00 | 7.85 |
| 3 | 0.21 | 0.30 | 0.84 | 1.52 | |
| 5 | 0.02 | 0.06 | 0.43 | 0.80 | |
②维持温度不变,若要使CO的转化率升高,可以改变的条件是加水/增大H2O和CO投料比/减小生成物浓度(分离出产物).
③温度为T3℃、$\frac{n({H}_{2}0)}{n(C0)}$=1时,变换后的平衡混合气体中H2的体积分数是47.8%.
 则该物质属于( )
则该物质属于( )| A. | 烯烃 | B. | 无机物 | C. | 有机物 | D. | 烷烃 |
| A. | 无色溶液:Al3+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、Fe3+、NO3- | |
| C. | FeCl3溶液:K+、Na+、NO3-、SCN- | |
| D. | 由水电离出的C(H+)=10-13mol/L的溶液:Na+、K+、SiO32-、NO3- |
| A. | 酒精着火时应立即用水灭火 | |
| B. | 实验室制蒸馏水时应在蒸馏烧瓶中放入几粒碎瓷片 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 用试管加热碳酸氢钠固体时使试管口竖直向上 |
| A. | F- | B. | Ne | C. | H3O+ | D. | NH2- |