题目内容
15.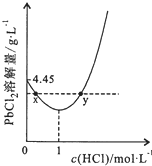 20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )| A. | 盐酸浓度越大,Ksp(PbCl2)越大 | |
| B. | PbCl2能与一定浓度的盐酸反应 | |
| C. | x、y两点对应的溶液中c(Pb2+)相等 | |
| D. | 往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s) |
分析 PbCl2是微溶化合物,溶于水存在下列平衡:PbCl2(s)?Pb2+(aq)+2Cl-(aq),由图象可知,PbCl2(s)在不同浓度盐酸中的溶解度不同,先减小后增大,由图象可知在浓度为1mol/L时溶解量最小,小于1mol/L时,抑制氯化铅的溶解,大于1mol/L时,可发生络合反应而促进溶解,以此解答该题.
解答 解:A.Ksp(PbCl2)只受温度的影响,温度不变,则Ksp(PbCl2)不变,故A错误;
B.大于1mol/L时,可发生络合反应而促进溶解,故B正确;
C.x、y两点对应的溶液中的溶质不同,则c(Pb2+)不等,故C错误;
D.往含Pb2+的溶液中加入过量浓盐酸,发生络合反应,产物不是PbCl2,故D错误.
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,准确分析图象中坐标的含义及图象的变化是解决本题的关键,题目难度不大.

练习册系列答案
相关题目
12.下列实验操作正确的是( )
①用50mL量筒量取5.2mL稀硫酸;
②用分液漏斗分离苯和四氯化碳的混合物
③用托盘天平称量17.7g氯化钠晶体
④向小试管中加入100ml稀盐酸.
①用50mL量筒量取5.2mL稀硫酸;
②用分液漏斗分离苯和四氯化碳的混合物
③用托盘天平称量17.7g氯化钠晶体
④向小试管中加入100ml稀盐酸.
| A. | ①② | B. | ②③ | C. | ③ | D. | ②④ |
13.萃取碘水中的碘,可用的萃取剂是 ①四氯化碳 ②苯 ③酒精( )
| A. | 只有① | B. | ①和② | C. | ①和③ | D. | ①②③ |
3.已知25℃时,Ka(HF)=3.6×10-4mol•L-1,Ksp(CaF2)=1.46×10-10mol3•L-3.现向1L0.2mol•L-1HF溶液中加入1L0.2mol•L-1CaCl2溶液,则下列说法中,正确的是( )
| A. | 25℃时,0.1mol•L-1HF 溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 加入CaCl2溶液后体系中的c(H+)不变 | |
| D. | 该体系中HF与CaCl2反应产生沉淀 |
10.向饱和BaSO4溶液中加水,下列叙述中正确的是( )
| A. | BaSO4的溶解度增大,Ksp不变 | B. | BaSO4的溶解度、Ksp均增大 | ||
| C. | BaSO4的溶解度、Ksp均不变 | D. | BaSO4的溶解度不变,Ksp增大 |
20.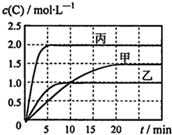 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
下列说法正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T3 |
| 反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 达平衡时A(g)的浓度:乙=丙>甲 | |
| B. | 甲容器中达平衡时B(g)的转化率为75% | |
| C. | 温度分别为T1、T2时,该反应的平衡常数:K(T1)<K(T2) | |
| D. | 丙容器中达到平衡后,若同时向容器中再充入1mol A(g)、1mol B(g)、1molC(g),则平衡向逆反应方向移动 |
5.用于制造隐形飞机的某种物质结构为: 则该物质属于( )
则该物质属于( )
 则该物质属于( )
则该物质属于( )| A. | 烯烃 | B. | 无机物 | C. | 有机物 | D. | 烷烃 |