题目内容
5.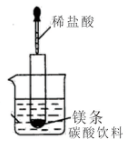 (1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.
(1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.试回答下列问题:
①实验中观察到的现象是镁片上有大量气泡,镁片逐渐溶解,烧杯中溶液变浑浊.
②产生上述实验现象的原因是镁与盐酸反应产生H2,该反应为放热反应,受热碳酸分解生成二氧化碳气体.
③写出有关的离子方程式Mg+2H+=Mg2++H2↑.
④由实验推知,镁条和盐酸的总能量大于MgCl2和H2的总能量(填“大于”、“等于”或“小于”).
(2)某同学用50ml 0.4mol/L盐酸、50ml 0.45mol•L-1NaOH溶液和课本实验装置进行中和热的测定:
①实验中所用的玻璃仪器除大、小烧杯,量筒、温度计外,还有量热计
②实验中测得放出的热量为1.138KJ,则所测得的中和热△H=-56.9kJ/mol
③上述实验实测中和热数据与57.3 KJ•mol-1有偏差,产生偏差的原因可能是CD.
A、实验装置保温、隔热效果差 B、分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C、量取盐酸的体积时仰观读数 D、误用了0.5mol•L-1NaOH溶液.
分析 (1)如图所示的实验中,所试管内滴入稀盐酸,盐酸与镁剧烈反应放出氢气,同时反应放出的热量,碳酸在溶液中不稳定分解生成二氧化碳气体.
(2)①测反应热实验中所用的玻璃仪器除大、小烧杯,量筒、温度计、量热计;
②实验所测得的中和热△H=-$\frac{Q}{n}$,据此计算;
③A.实验装置保温、隔热效果差,热量散失,导致反应后的温度低;
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失,导致反应后的温度低;
C.量取HCl溶液的体积时仰视读数,导致放出的热量多;
D.误用了0.5mol•L-1NaOH则氢氧化钠量多,导致温度偏高.
解答 解:(1)①镁与盐酸剧烈反应,可观察到产生大量气体,反应放出热量使溶液温度升高,分解,观察到冒气泡,
故答案为:镁片上有大量气泡,镁片逐渐溶解,烧杯中溶液产生气泡;
②镁与盐酸剧烈反应,产生氢气并放出大量的热,由于碳酸温度升高而分解生成二氧化碳气体;
故答案为:镁与盐酸反应产生H2,该反应为放热反应,受热碳酸分解生成二氧化碳气体;
③镁与盐酸发生置换反应,生成氯化镁和氢气,反应的化学方程式为Mg+2HCl═MgCl2+H2↑,
离子方程式为:Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑;
④当反应物的能量高于生成物的能量时,反应是放热反应,故镁条和盐酸的总能量大于MgCl2和H2的总能量,故答案为:大于;
(2)①实验中所用的玻璃仪器除大、小烧杯,量筒、温度计、量热计,故答案为:量热计;
②实验中测得放出的热量为1.138KJ,则所测得的中和热△H=-$\frac{Q}{n}$=-$\frac{1.138kJ}{0.05L×0.4mol/L}$=-56.9kJ/mol,故答案为:-56.9kJ/mol;
③A.实验装置保温、隔热效果差,热量散失,导致反应后的温度低,故错误;
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失,导致反应后的温度低,故错误;
C.量取HCl溶液的体积时仰视读数,导致放出的热量多,故正确;
D.误用了0.5mol•L-1NaOH则氢氧化钠量多,导致温度偏高,故正确;
故选CD.
点评 本题考查了化学反应现象和能量变化分析,注意分析通过化学变化放热而使溶液温度升高,掌握特征和基础是解决问题的关键.

 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案| A. | 将二氧化硫通入到紫色石蕊溶液中,溶液先变红后褪色 | |
| B. | 原电池工作时负极质量一定减少 | |
| C. | 红热的铁与水蒸气反应生成氧化铁和氢气 | |
| D. | 石油的分馏属于物理变化,煤的干馏属于化学变化 |
| A. | 2mol氯原子 | B. | 2g氯元素 | ||
| C. | 2.408×1024个氯原子 | D. | 4g氯分子 |
| A. | 只有① | B. | ①和② | C. | ①和③ | D. | ①②③ |
| A. | Ba(OH)2═Ba2++2OH- | B. | NaHSO4═H++Na++SO42- | ||
| C. | MgCl2═Mg2++2Cl- | D. | NaHCO3═H++Na++CO32- |
| A. | 25℃时,0.1mol•L-1HF 溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 加入CaCl2溶液后体系中的c(H+)不变 | |
| D. | 该体系中HF与CaCl2反应产生沉淀 |
| A. | BaSO4的溶解度增大,Ksp不变 | B. | BaSO4的溶解度、Ksp均增大 | ||
| C. | BaSO4的溶解度、Ksp均不变 | D. | BaSO4的溶解度不变,Ksp增大 |