题目内容
5.二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ•mol-1 ①
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-24.5kJ•mol-1 ②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1kJ•mol-1 ③
(1)下说法正确的是A
A.反应①的△S<0、△H<0,所以能在较低温度下自发进行.
B.反应③的H2O与CO的生成速率之比为1:1时,表示该反应已经达到平衡状态
C.反应②属于加成反应
(2)反应①合成的甲醇在工业上可以用作燃料电池,请写出甲醇燃料电池(KOH溶液)负极电极反应式CH3OH+8OH--6e-═CO32-+6H2O,电池总反应式2CH3OH+3O2+4OH-═2CO32-+6H2O.
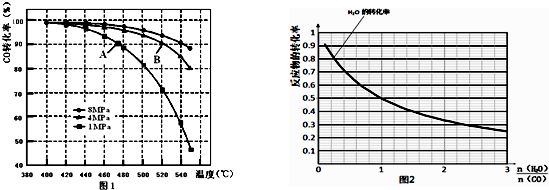
(3)当合成气中CO与H2的物质的量之比恒定时,温度、压强对CO转化率影响如图1所示,图1中A点的v(逆)<B点的v(正)(填“>”、“<”或“=”),说明理由B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率.
(4)一定温度下,密闭容器中发生反应③,该反应的平衡常数表达式k=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$;水蒸气的转化率与n(H2O)∕n(CO)的关系如图2,计算该温度下反应③的平衡常数K=1.在图2中作出一氧化碳的转化率与n(H2O)∕n(CO)的曲线.
分析 (1)A.根据△G=△H-T△S判断;
B.反应进行到任何时候H2O与CO的生成速率之比都为1:1;
C.反应②属于取代反应;
(2)燃料电池的负极上是燃料发生失电子发生氧化反应,碱性条件下甲醇被氧化生成碳酸根离子;
(3)B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率;
(4)根据化学平衡常数概念写K;由图可知,$\frac{n({H}_{2}O)}{n(CO)}$=1时水的转化率为0.5,令水、CO的起始物质的量均为1mol,转化的水为0.5mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1 1 0 0
变化量(mol):0.5 0.5 0.5 0.5
平衡量(mol):0.5 0.5 0.5 0.5
由于反应前后气体物质的量不变,用物质的量代替浓度代入K计算,
$\frac{n({H}_{2}O)}{n(CO)}$越大CO的转化率越大,$\frac{n({H}_{2}O)}{n(CO)}$=1时,CO与水的转化率相等为50%.
解答 解:(1)A.反应①的△S<0、△H<0,根据△G=△H-T△S判断:在较低温度下自发进行,故A正确;
B.反应进行到任何时候H2O与CO的生成速率之比都为1:1,故B错误;
C.反应②属于取代反应,故C错误;
故答案为:A;
(2)燃料电池中,负极上甲醇失电子发生氧化反应,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,碱性条件下甲醇被氧化生成碳酸根离子,总方程式为2CH3OH+3O2+4OH-═2CO32-+6H2O,
故答案为:CH3OH+8OH--6e-═CO32-+6H2O;2CH3OH+3O2+4OH-═2CO32-+6H2O;
(3)B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率,故A点的v(逆)<B点的v(正);
故答案为:<;B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率;
(4)CO(g)+H2O(g)?CO2(g)+H2(g)的K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$;
由图可知,$\frac{n({H}_{2}O)}{n(CO)}$=1时水的转化率为0.5,令水、CO的起始物质的量均为1mol,转化的水为0.5mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1 1 0 0
变化量(mol):0.5 0.5 0.5 0.5
平衡量(mol):0.5 0.5 0.5 0.5
由于反应前后气体物质的量不变,用物质的量代替浓度计算平衡常数,则平衡常数K=$\frac{0.5×0.5}{0.5×0.5}$=1,
$\frac{n({H}_{2}O)}{n(CO)}$越大CO的转化率越大,$\frac{n({H}_{2}O)}{n(CO)}$=1时,CO与水的转化率相等为50%,一氧化碳的转化率与$\frac{n({H}_{2}O)}{n(CO)}$的曲线变化为: ,
,
故答案为:$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$;1; .
.
点评 本题考查化学计算与影响因素、化学平衡图象、平衡状态判断、化学平衡常数、反应自发性等,为高频考点,侧重于学生的分析能力和计算能力的考查,(3)中作图为易错点,学生容易忽略交点时时转化率问题.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | 2Na+2H2O=2NaOH+H2↑ | B. | Na2O+H2O=2NaOH | ||
| C. | H2O $\frac{\underline{\;通电\;}}{\;}$ H2↑+O2↑ | D. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 |
| A. |  为腐蚀品,当心腐蚀 | B. |  有毒物质,当心中毒 | ||
| C. |  为易燃物质,当心火灾 | D. |  为爆炸性物质,当心爆炸 |
| A. | Ba(OH)2═Ba2++2OH- | B. | NaHSO4═H++Na++SO42- | ||
| C. | MgCl2═Mg2++2Cl- | D. | NaHCO3═H++Na++CO32- |
| A. | Mg | B. | Mg | C. | $\frac{M}{6.02×1{0}^{23}}$g | D. | Mg |
| A. | BaSO4的溶解度增大,Ksp不变 | B. | BaSO4的溶解度、Ksp均增大 | ||
| C. | BaSO4的溶解度、Ksp均不变 | D. | BaSO4的溶解度不变,Ksp增大 |
 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,结构如图所示.则12g石墨烯中含有0.5NA个6元环.
(2)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol
副反应有:
CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=a kJ/mol
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=b kJ/mol
CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol
①若要有利于甲醇的生成,除了改变温度外,还可以采取的两种措施是增大压强、选用合适的催化剂;
②甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为CH3OH(g)+1/2O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1.
(3)苯乙烷(C8H10)生产苯乙烯(C8H8)的反应:C8H10(g)?C8H8(g)+H2(g)△H>0.T1℃下,将0.40mol苯乙烷充入2L密闭容器中反应,不同时间容器内n(C8H10)如下表:
| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
②改变温度为T2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为40%.
(4)用惰性电极电解葡萄糖和硫酸钠混合溶,可以制得葡萄糖酸[CH2OH(CHOH)4COOH]和己六醇[CH2OH(CHOH)4CH2OH].葡萄糖酸在阳极生成,对应的电极反应式CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
| A. | 0~5min 时用H2O(g)表示的平均反应速率为1.2×10-3 mol/( L.min) | |
| B. | 5min~10min 改变的条件是再加入了0.1mol H2O(g) | |
| C. | 200℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.01molCO2(g)、0.01molH2(g),达平衡时,CO(g)为1.2×10-3mol/L | |
| D. | 300℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.02molCO2(g)、0.02molH2(g),则开始反应时ν(正)<ν(逆) |