题目内容
10.在饱和硫酸铜溶液中加入160克无水硫酸铜,析出的晶体质量是250克吗?为什么?分析 在饱和硫酸铜溶液中加入160g无水硫酸铜,发生的反应为CuSO4+5H2O=CuSO4•5H2O,析出的晶体由两部分构成,一部分是反应生成的,另一部分是消耗了溶剂之后饱和溶液析出的.
解答 解:加入的160g硫酸铜与水反应,设消耗水的质量为x,生成CuSO4•5H2O的质量为y,则
CuSO4+5H2O=CuSO4•5H2O
160 90 250
160g x y
$\frac{160}{160g}=\frac{90}{x}=\frac{250}{y}$,解得x=90g,y=250g,
原溶液为饱和硫酸铜溶液,消耗了90g水,也会析出一定质量的CuSO4•5H2O,
因此在饱和硫酸铜溶液中加入160g无水硫酸铜,析出的晶体质量的质量大于250g,
答:不是,原溶液为饱和硫酸铜溶液,加入的160g硫酸铜与水反应消耗了90g水,导致析出的晶体质量大于250g.
点评 本题考查了饱和溶液的概念以及无机物的化学性质,难度中等,明确硫酸铜与水发生反应生成硫酸铜晶体之外,消耗的水也会使饱和溶液中析出相应质量的晶体.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
20.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol Na2O2与水反应时,转移电子的数目为2 NA | |
| B. | 标准状况下,22.4 L水中含有水分子的数目为NA | |
| C. | 14 g N2中含有电子的数目为7 NA | |
| D. | NA个一氧化碳分子和0.5 molCH4的质量比为7:4 |
18.关于下图装置,下列说法不正确的是( )
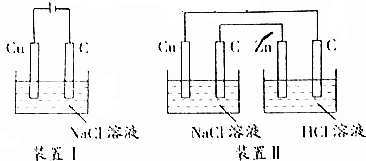

| A. | 装置Ⅰ通电一段时间,可看见溶液变蓝,碳棒上有大量红色物质附着 | |
| B. | 装置Ⅱ能加速铜电极的腐蚀 | |
| C. | 装置Ⅰ将电源换成灵敏电流表,观察到有电流通过 | |
| D. | 装置Ⅰ通电30s后反接电源,再过30s后电极质量未恢复 |
5.乙烯通过一步反应不能制取的物质是( )
| A. | CH3CH2OH | B. | CH3CH2Cl | C. | CH2BrCH2Br | D. | CH2=CHCl |
15.浓度均为1mol/L的KCl、CuCl2、AlCl3三种溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3:2:1时,所用KCl、CuCl2、AlCl3三种溶液的体积比为( )
| A. | 9:6:2 | B. | 9:3:1 | C. | 6:3:2 | D. | 6:3:1 |
19.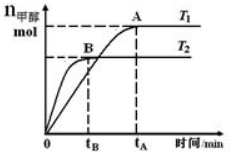 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )
 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )| A. | CO合成甲醇的反应为吸热反应 | |
| B. | 该反应在T1时的平衡常数比T2时的大 | |
| C. | 平衡常数K=$\frac{c(CO)•{c}^{2}({H}_{2})}{c(C{H}_{2}OH)}$ | |
| D. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小 |
20.在 A+2B?3C+4D 反应中,表示该反应速率最快的是( )
| A. | v(A)=0.3 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=1 mol/(L•min) |
