题目内容
20.在 A+2B?3C+4D 反应中,表示该反应速率最快的是( )| A. | v(A)=0.3 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=1 mol/(L•min) |
分析 根据比值法比较大小,即由某物质表示的速率与该物质的化学计量数之比,比值越大,速率越快,注意单位的统一.
解答 解:A、v(A)=0.3 mol/(L•s),即v=0.3 mol/(L•s);
B、v(B)=0.5 mol/(L•s),即v=0.25mol/(L•s);
C、v(C)=0.8 mol/(L•s),即v=0.27mol/(L•s);
D、v(D)=1 mol/(L•min),即v(D)=$\frac{1}{60}$mol/(L•s),v=$\frac{\frac{1}{60}}{4}$mol/(L•s)=0.0042mol/(L•s);
表示该反应速率最快的是A.
故选A.
点评 本题考查反应速率快慢的比较,难度不大,注意比较常用方法有:1、归一法,即按速率之比等于化学计量数之比转化为用同一物质表示的速率,2、比值法,即由某物质表示的速率与该物质的化学计量数之比,比值越大,速率越快.

练习册系列答案
相关题目
11.将一定量的锌与浓度为18.5mol/L的100mL浓硫酸充分反应后,锌完全溶解,同时生成26.88L标准状况下的气体,反应后测得溶液中氢离子浓度为1.0mol/L,则生成的气体的物质的量之比为( )
| A. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{1}$ | B. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{4}{1}$ | C. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{4}$ | D. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{3}{2}$ |
8.下列各组气体中,在通常条件下能稳定共存的是( )
| A. | NH3、O2、HCl | B. | N2、O2、CO2 | C. | CO2、NO、O2 | D. | N2、H2S Cl2 |
15.下列说法正确的是( )
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| D. | 用10mL量筒量取9.2mL NaCl溶液 |
12.下列试剂不能把等物质的量浓度的Na2CO3溶液、NaHCO3溶液鉴别开的是( )
| A. | CaCl2溶液 | B. | 澄清石灰水 | C. | 稀盐酸 | D. | 酚酞溶液 |
13.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
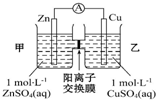

| A. | 铜电极上发生反应Cu-2e-=Cu2+ | |
| B. | 电池工作一段时间后,乙池的c(SO42- )减小 | |
| C. | 电子从锌极经过导线移向铜极 | |
| D. | 电池工作一段时间后,甲池的c(Zn2+ )增加 |
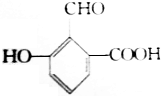 具有的三种官能团分别是:羟基、醛基和羧基,所以这种化合物可看作酚类、醛类和羧酸类.
具有的三种官能团分别是:羟基、醛基和羧基,所以这种化合物可看作酚类、醛类和羧酸类.