题目内容
2.按要求填写计算结果:(1)由N2和CO2组成的28g混合气体在标准状况下的体积为17.92L,则原混合气体的平均摩尔质量为35g/mol.
(2)已知:20℃时,Na2CO3溶解度为21.8g,NaHCO3溶解度为9.6g.20℃时,将21.2g Na2CO3溶于103.6g水中配成溶液,然后向此溶液中通入足量CO2,则析出晶体的质量为24g.
分析 (1)根据M=$\frac{m}{n}$计算混合气体的平均摩尔质量;
(2)CO2通入Na2CO3溶液中,发生Na2CO3+CO2+H2O=2NaHCO3,20℃时,Na2CO3溶解度为21.8g,NaHCO3溶解度为9.6g,根据反应方程式以及21.2gNa2CO3溶于103.6g水中配成溶液的条件求解,沉淀为NaHCO3,结合数据求解析出晶体的质量.
解答 解:(1)混合气体在标准状况下的体积为17.92L,物质的量为n=$\frac{17.92L}{22.4L/mol}$=0.8mol,混合气体平均摩尔质量=$\frac{28g}{0.8mol}$=35g/mol,故答案为:35g/mol;
(2)21.2gNa2CO3的物质的量为n=$\frac{m}{M}$=$\frac{21.2g}{106g/mol}$=0.2mol,在Na2CO3溶液中通入足量二氧化碳气体发生Na2CO3+CO2+H2O=2NaHCO3,0.2molNa2CO3消耗0.2molH2O,生成0.4molNaHCO3,m(NaHCO3)=nM=0.4mol×84g/mol=33.6g,剩余水为:103.6g-0.2mol×18g/mol=100g,NaHCO3溶解度为9.6g,应溶解9.6gNaHCO3,析出NaHCO3:33.6g-9.6g=24g,
故答案为:24.
点评 本题考查物质的量的相关计算,侧重于学生的计算能力的考查,注意对公式的理解,难度不大.

练习册系列答案
相关题目
13.一定条件下,体积为1L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )
| A. | 以X浓度变化表示的反应速率为0.01mol•L-1•S-1 | |
| B. | 将容器体积变为2L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
7.下列各物质的颜色变化不是由平衡移动引起的是( )
| A. | H2、I2、HI平衡混合气体加压颜色变深 | |
| B. | 氯水光照颜色变浅 | |
| C. | NO2、N2O4混合气体加热颜色变深 | |
| D. | FeCl和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
14.如图为铜丝与浓硫酸反应并验证其产物性质的实验装置.
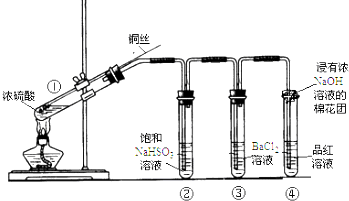
(1)①中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)②中饱和NaHSO3溶液的作用是除去除去①中挥发出的硫酸.加热一段时间后,③中溶液依然澄清,想要立即终止铜与硫酸的反应,最恰当的方法是a.
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
完成上述反应的离子方程式.
(4)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色.取少量蓝色溶液于试管中,滴加NaOH溶液过量,出现的现象是开始没有明显现象,后有蓝色沉淀生成.

(1)①中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)②中饱和NaHSO3溶液的作用是除去除去①中挥发出的硫酸.加热一段时间后,③中溶液依然澄清,想要立即终止铜与硫酸的反应,最恰当的方法是a.
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
| 加入试剂 | 现象 | 反应的离子方程式 | |
| 第一份 | 加入NaOH溶液 | 有白色沉淀生成 | SO2+2OH-═SO32-+H2OBa2++SO32-═BaSO3↓ |
| 第二份 | 加入氯水 | 有白色沉淀生成 | SO2+Cl2+H2O═4H++2Cl-+SO42-Ba2++SO42-═BaSO4↓ |
(4)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色.取少量蓝色溶液于试管中,滴加NaOH溶液过量,出现的现象是开始没有明显现象,后有蓝色沉淀生成.
11.将一定量的锌与浓度为18.5mol/L的100mL浓硫酸充分反应后,锌完全溶解,同时生成26.88L标准状况下的气体,反应后测得溶液中氢离子浓度为1.0mol/L,则生成的气体的物质的量之比为( )
| A. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{1}$ | B. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{4}{1}$ | C. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{4}$ | D. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{3}{2}$ |
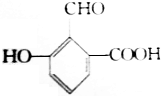 具有的三种官能团分别是:羟基、醛基和羧基,所以这种化合物可看作酚类、醛类和羧酸类.
具有的三种官能团分别是:羟基、醛基和羧基,所以这种化合物可看作酚类、醛类和羧酸类.