题目内容
18.关于下图装置,下列说法不正确的是( )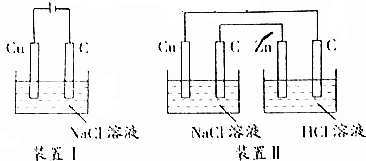
| A. | 装置Ⅰ通电一段时间,可看见溶液变蓝,碳棒上有大量红色物质附着 | |
| B. | 装置Ⅱ能加速铜电极的腐蚀 | |
| C. | 装置Ⅰ将电源换成灵敏电流表,观察到有电流通过 | |
| D. | 装置Ⅰ通电30s后反接电源,再过30s后电极质量未恢复 |
分析 A.装置I中Cu在阳极失电子,氢离子在阴极得电子;
B.装置II中Zn为负极,C为正极,Cu与正极相连为阳极;
C.装置I中Cu、C、氯化钠溶液能构成原电池;
D.装置I中电解生成氢氧化铜沉淀.
解答 解:A.装置I中Cu在阳极失电子生成铜离子,氢离子在阴极得电子,同时生成氢氧化钠,所以溶液中铜离子与氢氧根离子结合会生成氢氧化铜沉淀,得不到蓝色溶液,故A错误;
B.装置II中Zn为负极,C为正极,Cu与正极相连为阳极,Cu在阳极生成失电子生成铜离子,能加速铜的腐蚀,故B正确;
C.装置Ⅰ将电源换成灵敏电流表,Cu、C、氯化钠溶液能构成原电池,负极铜失电子,正极上氧气得电子,铜发生吸氧腐蚀,所以观察到有电流通过电流表,故C正确;
D.装置I中Cu在阳极失电子生成铜离子,氢离子在阴极得电子,同时生成氢氧化钠,所以溶液中铜离子与氢氧根离子结合会生成氢氧化铜沉淀,通电30s后反接电源,阳极上氯离子失电子,阴极上氢离子得电子,不能生成铜单质,所以电极质量未恢复,故D正确.
故选A.
点评 本题考查了原电池原理和电解原理的应用,题目难度中等,试题综合性强,侧重对基础知识巩固和训练的同时,主要是侧重对学生综合能力的培养.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
9.关于反应方程式Cl2+2I-═2Cl-+I2,说法不正确的是( )
| A. | Cl2是氧化剂 | B. | I2是还原产物 | ||
| C. | 上述反应属于置换反应 | D. | 上述反应属于离子反应 |
6.科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料做惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e→2O2-).下列说法不正确的是( )


| A. | c电极的名称为正极,d电极上的电极反应式为CH4-8e-+4O2-═CO2+2H2O | |
| B. | 如图2所示,a电极上的电极反应式为4OH--4e-═2H2O+O2↑ | |
| C. | 如图2所示电解100mL0.5mol/LCuSO4溶液,若a电极产生56mL(标准状况)气体,则所得溶液的pH=1(不考虑溶液体积变化) | |
| D. | 若要使电解质溶液恢复到电解前的状态,可加入Cu2(OH)2CO3 |
13.一定条件下,体积为1L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )
| A. | 以X浓度变化表示的反应速率为0.01mol•L-1•S-1 | |
| B. | 将容器体积变为2L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
7.下列各物质的颜色变化不是由平衡移动引起的是( )
| A. | H2、I2、HI平衡混合气体加压颜色变深 | |
| B. | 氯水光照颜色变浅 | |
| C. | NO2、N2O4混合气体加热颜色变深 | |
| D. | FeCl和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
8.下列各组气体中,在通常条件下能稳定共存的是( )
| A. | NH3、O2、HCl | B. | N2、O2、CO2 | C. | CO2、NO、O2 | D. | N2、H2S Cl2 |
 ,
, .
.