题目内容
5.乙烯通过一步反应不能制取的物质是( )| A. | CH3CH2OH | B. | CH3CH2Cl | C. | CH2BrCH2Br | D. | CH2=CHCl |
分析 乙烯中存在碳碳双键,可以与水发生加成反应生成乙醇,与HCl加成生成氯乙烷,与溴单质加成生成1,2-二溴乙烷,据此解答即可.
解答 解:A.乙醇可以通过乙烯与水加成生成,故A不选;
B.氯乙烷可以通过乙烯与HCl加成反应得到,故B不选;
C.1,2-二溴乙烷可以是乙烯与溴反应得到,故C不选;
D.不能通过乙烯一步反应得到,故D选,
故选D.
点评 本题主要考查的是乙烯的化学性质,主要体现的是加成反应的定义,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
15.阿司匹林的结构简式如图,把阿司匹林放在足量的氢氧化钠溶液中煮沸,能发生反应的化学键是( )


| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
16.已知苹果酸的结构简式为: 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A. | 苹果酸分子中存在5种不同种类的氢原子 | |
| B. | 1mol苹果酸可与3mol NaOH完全中和 | |
| C. | 苹果酸与 互为同分异构体 互为同分异构体 | |
| D. | 苹果酸分子中的所有碳原子可能处在同一条直线上 |
13.一定条件下,体积为1L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )
| A. | 以X浓度变化表示的反应速率为0.01mol•L-1•S-1 | |
| B. | 将容器体积变为2L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
14.如图为铜丝与浓硫酸反应并验证其产物性质的实验装置.
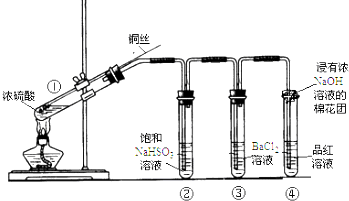
(1)①中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)②中饱和NaHSO3溶液的作用是除去除去①中挥发出的硫酸.加热一段时间后,③中溶液依然澄清,想要立即终止铜与硫酸的反应,最恰当的方法是a.
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
完成上述反应的离子方程式.
(4)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色.取少量蓝色溶液于试管中,滴加NaOH溶液过量,出现的现象是开始没有明显现象,后有蓝色沉淀生成.

(1)①中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)②中饱和NaHSO3溶液的作用是除去除去①中挥发出的硫酸.加热一段时间后,③中溶液依然澄清,想要立即终止铜与硫酸的反应,最恰当的方法是a.
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
| 加入试剂 | 现象 | 反应的离子方程式 | |
| 第一份 | 加入NaOH溶液 | 有白色沉淀生成 | SO2+2OH-═SO32-+H2OBa2++SO32-═BaSO3↓ |
| 第二份 | 加入氯水 | 有白色沉淀生成 | SO2+Cl2+H2O═4H++2Cl-+SO42-Ba2++SO42-═BaSO4↓ |
(4)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色.取少量蓝色溶液于试管中,滴加NaOH溶液过量,出现的现象是开始没有明显现象,后有蓝色沉淀生成.
15.下列说法正确的是( )
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| D. | 用10mL量筒量取9.2mL NaCl溶液 |
 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题:
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题: