题目内容
9.甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景.(1)已知反应CO(g)+2H2(g)═CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如表:
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:
CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1<0,
CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.

①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)
②T1<T2 (填“>”、“<”、“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如图2所示.则△H1<△H3(填“>”、“<”、“=”),理由是由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3.
分析 (1)根据反应热=反应物的总键能-生成物的总键能计算;
(2)①压强越大反应速率越快,所以a、b两点的反应速率:v(a)<v(b);
②压强相同时一氧化碳的转化率高,所以平衡正向移动,而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
③根据化学平衡时正逆反应速率相等,各物质含量不再改变分析;
④结合化学平衡三行计算列式计算平衡物质的物质的量,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;
(3)反应1、2、3其对应的平衡常数分别为K1、K2、K3,根据图1它们随温度变化的曲线结合盖斯定律进行分析解答.
解答 解:(1)反应热=反应物的总键能-生成物的总键能,则△H=2×436+x-343-413×3-465=-99,解得x=1076;
故答案为:1076;
(2)①压强越大反应速率越快,所以a、b两点的反应速率:v(a)<v(b);
故答案为:<;
②该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
故答案为:<;该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
③a.H2的消耗速率是CH3OH生成速率的2倍均为正反应速率,不能说正逆反应速率相等,故a错误;
b.CH3OH的体积分数随着反应的进行增大,不再改变时化学平衡,故b正确;
c.混合气体的总质量不变,容器可变,则混合气体的体积减小,密度增大,不再改变时化学平衡,故c正确;
d.CO和CH3OH的物质的量之和保持不变,不能说明化学平衡,故d错误;
故答案为:bc;
④a点的一氧化碳转化率为50%,总压为0.5MPa,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
而一氧化碳转化率为50%,所以x=0.5mol,Kp=$\frac{\frac{0.5}{2}×0.5}{\frac{0.5}{2}×0.5×(\frac{1}{2}×0.5)^{2}}$=1.6×10-7;
故答案为:1.6×10-7;
(3)由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3.;
故答案为:<;由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3.
点评 本题考查热化学方程式书写、化学平衡图象、影响化学平衡的因素、化学平衡常数等,难度中等,掌握利用“定一议二”原则分析和化学平衡常数的计算,注意对题目信息的读取.

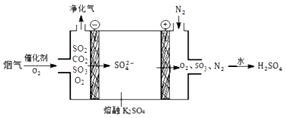 煤炭燃烧中会产生大量烟气容易透成污染,用下图所示的电解池在较高温度下反应,可以净化烟气,月下列列断不正确的是( )
煤炭燃烧中会产生大量烟气容易透成污染,用下图所示的电解池在较高温度下反应,可以净化烟气,月下列列断不正确的是( )| A. | 据图可知,阳极反应式为SO42--2e-=SO2↑+O2↑ | |
| B. | SO2在阴极与O2反应生成硫酸根,则方程式为SO2+O2+2e-=SO42- | |
| C. | 阳极失去2mol电子时,理论上可以得到标准状况下11.2L氧气 | |
| D. | CO2不参与电极反应,净化器中CO2浓度升高 |
| A. | 常温常压下,2.24 LSO2中所含氧原子数为0.2NA | |
| B. | 将1 mol Cl2通入水中,HC1O、Cl-、ClO-粒子数之和为2NA | |
| C. | 1 mol NO2与足量H2O反应,转移的电子数为NA | |
| D. | 0.1 mol熔融的NaHSO4中阳离子数目为0.lNA |
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2 (g)=4NO (g)+6H2O (L)△H1
②4NH3(g)+6NO(g)=5N2 (g)+6H2O (L)△H2
则反应 4NH3(g)+3O2(g)=2N2 (g)+6H2O (L)△H=$\frac{3△{H}_{1}+2△{H}_{2}}{5}$(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3L的恒容密闭容器中,投入4mol N2和9mol N2 在一定条件下合成氮,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则 T1、<T2(填“>”、“<”或“=”)
②T2K下,经过10min达到化学平衡状态,则o~10min内H2的平均速率v(H2)=0.1mol•L-1•min-1.
③下列图象分别代表焓变(△H),混合气体平均相对分子质量($\overline{M}$)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态是BC.

(3)电化学降解治理水中硝酸盐污染,在酸性条件下,电化学降解NO3-的原理如图1,阴极反应式为2NO3-+12H++10e-=N2↑+6H2O.

(4)通过控制溶液的pH对工业废水中的金属离子进行分离.图2是某些金属氢氧化物在不同浓度和pH的沉淀--溶解图象,图中直线上的点表示平衡状态.当溶液中的离子浓度小于1×10-5mol•L-1时,认为该离子沉淀完全.
由图可知Cu(OH)2的浓度积的值为1×10-21.8.
| B | C |
| D |
| A. | 简单离子的半径大小关系:C>E | |
| B. | D元素的气态氢化物比C元素的气态氢化物稳定 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | 由C、D、E三种元素组成的化合物只有一种 |


 ,可以表示35Cl-,也可以表示37Cl-
,可以表示35Cl-,也可以表示37Cl- 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子