题目内容
6.磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂.(1)磷元素位于元素周期表第周期族.AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为Al(OH)3.
(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:□CuSO4+□PH3+□H2O═□Cu3P↓+□H3PO4+□H2SO4
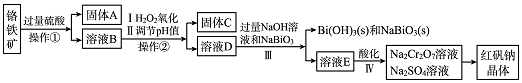
(3)工业制备PH3的流程如图所示.

①黄磷和烧碱溶液反应的化学方程式为P4+3NaOH+3H2O=PH3↑+3NaH2PO2,次磷酸属于一(填“一”“二”或“三”)元酸.
②若起始时有1molP4参加反应,则整个工业流程中共生成2.5mol PH3.(不考虑产物的损失)
分析 (1)原子结构中电子层数等于周期数,最外层电子数等于族序数,AlP遇水蒸气会发生反应放出PH3气体,根据元素守恒确定该反应的另一种产物的化学式;
(2)配平化学方程式,就是通过在各物质的化学式前面添加系数,使反应中每种原子个数在反应前后相等的过程,但对于复杂的化学反应通常通过观察,找出变化的特点或规律,常使用化合价来配平,保证化合价升高与降低的数相等即可;
(3)①根据图示信息:黄磷和烧碱溶液反应生成PH3↑、NaH2PO2,据此书写方程式,根据物质电离出的氢离子数目确定酸的元数;
②根据发生反应的过程寻找关系式,进行计算即可.
解答 解:(1)P处于第三周期,ⅤA族,AlP遇水蒸气会发生反应放出PH3气体,根据元素守恒,确定该反应的另一种产物是Al(OH)3,
故答案为:三;VA;Al(OH)3;
(2)该方程式中Cu价态由+2→+1,P价态由-3→+5,为保证化合价升降数相等,Cu3P与H3PO4计量数分别为8、3,CuSO4的系数是24,H2SO4系数是24,根据元素守恒,得到:24CuSO4+11PH3+12H2O═8Cu3P↓+3H3PO4+24H2SO4,故答案为:24,11,12,8,3,24;
(3)①根据图示信息:黄磷和烧碱溶液反应生成PH3↑、NaH2PO2,方程式为:P4+3NaOH+3H2O=PH3↑+3NaH2PO2,根据电离出的氢离子数目确定次磷酸属于一元酸;故答案为:P4+3NaOH+3H2O=PH3↑+3NaH2PO2;一;
②P4+3NaOH+3H2O=PH3↑+3NaH2PO2;2H3PO2=PH3↑+H3PO4,即P4~2.5PH3,若起始时有1molP4参加反应,则整个工业流程中共生成2.5molPH3.故答案为:2.5.
点评 本体考查学生氧化还原反应的配平以及电子转移的计算知识,属于综合知识的考查,难度中等.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案| A. | 干冰的主要成分是H2O | B. | SO2可大量用于漂白食品 | ||
| C. | 吸入CO可导致人体中毒 | D. | 小苏打的主要成份是Na2CO3 |
| A. | 我国古代四大发明之一黑火药由硫酸、硝酸和木炭按一定比例混合制成 | |
| B. | PH计不能用于酸碱中和滴定终点的判断 | |
| C. | 石油的分馏,煤的干馏、气化、液化均是物理变化 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
| A. | 78g苯中含有的碳碳双键的数目为3NA | |
| B. | 16g由Cu2S和CuO组成的混合物中含有的阳离子数为0.2NA | |
| C. | 将1molH2与1molI2充入一密闭容器中充分反应后,转移的电子数为2NA | |
| D. | 1mo1Fe与足量的浓硫酸共热反应,生成SO2的分子数为NA |
(1)已知反应CO(g)+2H2(g)═CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如表:
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:
CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1<0,
CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.

①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)
②T1<T2 (填“>”、“<”、“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如图2所示.则△H1<△H3(填“>”、“<”、“=”),理由是由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ |
(2)表中元素③的原子结构示意图
 ;元素⑨形成的氢化物的电子式
;元素⑨形成的氢化物的电子式 .
.(3)表中元素④、⑨形成的氢化物的稳定性顺序为HF>HCl(填化学式).
(4)表中元素⑧和⑨的最高价氧化物对应水化物的酸性强弱为HClO4>H2SO4(填化学式).
(5)表中元素③、④、⑥、⑦的原子半径大小为Na>Mg>O>F(填元素符号).
| 化学式 | 电离常数 |
| CH3COOH | K=1.7×10-5 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | H2CO3、HCO3-、CH3COO-、CN- | B. | HCO3-、CH3COOH、CN-、CO32- | ||
| C. | HCN、HCO3-、CN-、CO32- | D. | HCN、HCO3-、CH3COO-、CN- |