题目内容
4.联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N2O4反应能放出大量的热.(1)已知:2NO2(g)?N2O4(g),N2O4为无色气体.
①在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”)
②一定温度下,在密闭容器中反应2NO2(g)═N2O4(g)达到平衡,达到平衡状态的标志BDE.
A用NO2、N2O4的物质的量浓度变化表示的反应速率之比为2:1的状态
B单位时间内生成n mol N2O4的同时生成2nmolNO2
C 混合气体的密度不再改变的状态
D混合气体的颜色不再改变的状态
E混合气体的平均相对分子质量不再改变的状态
③其他条件不变时,下列措施能提高NO2转化率的是BC(填字母)
A 减小NO2的浓度 B 降低温度 C 增大压强 D 升高温度
(2)25℃时,0.1molN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出61.25kJ的热量.请写出该反应的热化学方程式:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)△H=-1225kJ/mol.
(3)17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时,n(NO2)=2.0mol,
n(N2O4)=1.6mol.则反应初始时,充入NO2的物质的量浓度为0.52mol/L;NO2的转化率为61.5%;该温度下该反应的平衡常数K为4;该温度下反应N2O4(g)?2NO2(g)的平衡常数K为0.25.
分析 (1)①△H-T△S<0的反应能够自发进行;
②可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
③平衡正向移动可以通过反应物的转化率;
(2)根据热化学方程式的意义以及热化学方程式的书写方法来写;
(3)依据反应方程式计算出反应初始时充入NO2的物质的量浓度,再根据c=$\frac{n}{V}$计算出二氧化氮的初始浓度;根据转化率=$\frac{反应消耗量}{反应初始量}$×100%计算出二氧化氮的转化率;根据K=$\frac{c({N}_{2}{O}_{4})}{c(N{O}_{2})^{2}}$计算出该反应的平衡常数;逆反应的平衡常数和正反应的平衡常数成倒数计算该温度下反应N2O4(g)?2NO2(g)的平衡常数K.
解答 解:(1)△H-T△S<0的反应能够自发进行,该反应△S<0,若反应能够自发进行,△H必须小于0,
故答案为:<;
②A.速率之比等于化学计量数之比,不能说明反应达到平衡状态,故A错误;
B.生成n mol N2O4的同时生成2nmolNO2,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C.密度始终不变,所以密度不变不能说明反应达到平衡状态,故C错误;
D.颜色不变,说明二氧化氮的浓度不变,反应达到平衡状态,故D正确;
E.平均相对分子质量不再改变,说明气体物质的量不变,反应达到平衡状态,故E正确;
答案为:BDE;
③A.减小二氧化氮的浓度,平衡逆向移动,NO2转化率减小,故A错误;
B.降低温度平衡向正向移动,NO2转化率增大,故B正确;
C.增大压强平衡正向移动,NO2转化率增大,故C正确;
D.升高温度,平衡逆向移动,NO2转化率减小,故D错误;
答案为:BC;
(2)1molN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放612.5kJ的热量,其热化学方程式为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)△H=-1225kJ/mol,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)△H=-1225kJ/mol;
(3)17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时n(NO2)=2.0mol,n(N2O4)=1.6mol,根据反应2NO2(g)?N2O4(g)可知反应初始时,充入NO2的物质的量为:2.0mol+1.6mol×2=5.2mol,则充入NO2的物质的量浓度为:$\frac{5.2mol}{10L}$=0.52mol/L;
平衡时消耗二氧化氮的物质的量为1.6mol×2=3.2mol,则NO2的转化率为:$\frac{3.2mol}{5.2mol}$≈61.5%;
该反应的平衡常数为:K=$\frac{c({N}_{2}{O}_{4})}{c(N{O}_{2})^{2}}$=$\frac{\frac{1.6}{10}}{(\frac{2.0}{10})^{2}}$=4;
该温度下反应N2O4(g)?2NO2(g)的平衡常数K′=$\frac{c({N}_{2}{O}_{4})}{c(N{O}_{2})^{2}}$=$\frac{1}{K}$=0.25mol/L,
故答案为:0.52mol/L;61.%;4;0.25.
点评 本题考查较为综合,题目难度中等,涉及化学平衡常数、转化率的计算、热化学方程式书写、反应自发进行的判断、化学平衡及其影响等知识,明确化学平衡常数的概念及表达式为解答关键,注意掌握反应自发进行的判断方法,试题培养了学生的分析、理解能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | NaOH和金属铝 | B. | NaOH 和CO2 | C. | Na2CO3和HCl | D. | Na和O2 |
| 操作 | 现象 |
| Ⅰ.向盛有4.0gNa2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a |
| Ⅱ.向溶液a中滴入两滴酚酞 | 溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
| Ⅲ.向溶液中加入少量MnO2粉末 | 又有大量气泡产生,产生的气体也能使带火星木条复燃 |
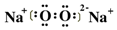 ,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表
,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表示反应的机理,写出Na218O2与H2O反应的化学方程式2Na218O2+2H2O═2Na18OH+2NaOH+18O2↑.
(2)操作Ⅱ中红色褪去的可能原因是溶液a中过量H2O2与酚酞发生反应.
(3)用反应2MnO4-+5H2O2+6H+=2Mn2++502↑+8H2O测定溶液a中H2O2含量.取20.00mL溶液a,用稀H2SO4(填化学式)酸化,用0.002mol•L-1KMnO4溶液滴定,至终点时平均消耗10.00mLKMnO4溶液.滴定时KMnO4溶液应装在酸(填酸或碱)式滴定管中,终点确定的方法是滴至最后一滴时溶液由紫色变为无色,且半分钟内不变色,经计算溶液a中c(H2O2)=0.0025mol•L-1
(4)向溶液a中滴加FeSO4溶液,发生反应的离子方程式为4H2O2+4Fe2++6H2O=O2↑+4Fe(OH)3↓+8Na+.
(5)向FeSO4溶液中加入一定量Na202固体,并以物质的量为2:1发生反应,反应中无气体生成,写出
反应的离子方程式3Na2O2+6 Fe2++6H2O=6Na++4Fe(OH)3↓+2Fe3+.
| A. | 78g苯中含有的碳碳双键的数目为3NA | |
| B. | 16g由Cu2S和CuO组成的混合物中含有的阳离子数为0.2NA | |
| C. | 将1molH2与1molI2充入一密闭容器中充分反应后,转移的电子数为2NA | |
| D. | 1mo1Fe与足量的浓硫酸共热反应,生成SO2的分子数为NA |
(1)已知反应CO(g)+2H2(g)═CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如表:
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:
CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1<0,
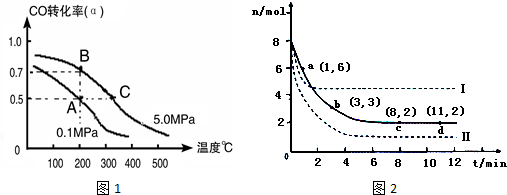
CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.

①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)
②T1<T2 (填“>”、“<”、“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如图2所示.则△H1<△H3(填“>”、“<”、“=”),理由是由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3.

下列说法正确的是( )
| A. | 溶解烧渣选用足量酸,可以从常见的强酸中选择任意一种,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,只需要缓慢加热至溶液出现少量晶体,停止加热利用余热蒸干即可 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| C. | 碳酸钙与稀盐酸反应:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| D. | 醋酸与氧化钠反应:Na2O+2H+═2Na++H2O |