题目内容
19.下列化学用语的理解或表示正确的为( )①CSO的电子式
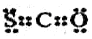
②次氯酸结构简式:H-Cl-0
③离子结构示意图:
 ,可以表示35Cl-,也可以表示37Cl-
,可以表示35Cl-,也可以表示37Cl-④比例模型:
 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子⑤对硝基苯酚的结构简式

⑥葡萄糖的实验式:CH2O.
| A. | ①③⑥ | B. | ②③④⑥ | C. | ①②④⑥ | D. | 全部正确 |
分析 ①CSO分子中含有一个碳氧双键和1个碳硫双键,各原子最外层都达到8电子稳定结构;
②次氯酸的中心原子为O原子,分子中不存在H-Cl键;
③35Cl-和37Cl-都是氯离子,其离子结构示意图相同;
④四氯化碳分子中,氯原子的原子半径大于碳原子,其比例模型不能用 表示;
表示;
⑤硝基中N原子与苯环C相连;
⑥实验式为分子中各原子的最简比,结合葡萄糖的分子式判断.
解答 解:①CSO为共价化合物,碳原子分别与氧原子和硫原子生成了两对共用电子对,其电子式为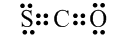 ,故①正确;
,故①正确;
②次氯酸分子中含有1个氢氧键和1个O-Cl键,正确的结构简式为:H-O-Cl,故②错误;
③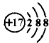 表示所有的氯离子,可以表示35Cl-,也可以表示37Cl-,故③正确;
表示所有的氯离子,可以表示35Cl-,也可以表示37Cl-,故③正确;
④ 可以表示甲烷,但是不能表示四氯化碳,四氯化碳中氯原子的原子半径大于碳原子,四氯化碳的比例模型为
可以表示甲烷,但是不能表示四氯化碳,四氯化碳中氯原子的原子半径大于碳原子,四氯化碳的比例模型为 ,故④错误;
,故④错误;
⑤对硝基苯酚中,硝基中N原子与苯环相连,其正确的结构简式为: ,故⑤错误;
,故⑤错误;
⑥实验式为分子中各原子的最简比,葡萄糖的分子式为C6H12O6,则葡萄糖的实验式:CH2O,故⑥正确;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及结构简式、比例模型、离子结构示意图、电子式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景.
(1)已知反应CO(g)+2H2(g)═CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如表:
则x=1076.
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:
CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1<0,
CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.

①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)
②T1<T2 (填“>”、“<”、“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如图2所示.则△H1<△H3(填“>”、“<”、“=”),理由是由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3.
(1)已知反应CO(g)+2H2(g)═CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如表:
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:
CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1<0,
CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.

①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)
②T1<T2 (填“>”、“<”、“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如图2所示.则△H1<△H3(填“>”、“<”、“=”),理由是由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3.
10.下列叙述正确的是( )
| A. | 非金属原子间以共价键结合的物质一定是共价化合物 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 凡是能电离出离子的化合物一定是离子化合物 | |
| D. | 凡是含有离子键的化合物一定是离子化合物 |
7.根据表提供的数据可知,在溶液中能大量共存的微粒组是( )
| 化学式 | 电离常数 |
| CH3COOH | K=1.7×10-5 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | H2CO3、HCO3-、CH3COO-、CN- | B. | HCO3-、CH3COOH、CN-、CO32- | ||
| C. | HCN、HCO3-、CN-、CO32- | D. | HCN、HCO3-、CH3COO-、CN- |
14.下列反应的离子方程式书写中,正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| C. | 碳酸钙与稀盐酸反应:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| D. | 醋酸与氧化钠反应:Na2O+2H+═2Na++H2O |
11. 一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )
 一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H20O | |
| B. | 该化合物可发生聚合反应 | |
| C. | 1 mol该化合物完全燃烧消耗19 mol O2 | |
| D. | 1mol该化合物与足量H2加成,最多消耗H23mol |
8.关于Na2CO3溶液,下列关系不正确的是( )
| A. | c(Na+)>2c(CO32-) | B. | c(Na+)=2 | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(H+) | D. | c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
9.下列对烃的分类不正确的是( )
| A. | CH4、CH2═CH2、CH2═CHCH═CH2均属于饱和链烃 | |
| B. | CH3CH2CH3、CH3CH═CH2、CH3CH═CHCH2CH═CH3均属于脂肪链烃 | |
| C. | CH3CH3、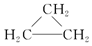 、C18H38均属于饱和烃 、C18H38均属于饱和烃 | |
| D. | 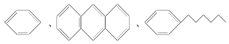 均属于芳香烃 均属于芳香烃 |
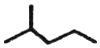 ②甲苯 ③ClCH=CHCl ④
②甲苯 ③ClCH=CHCl ④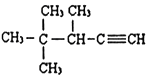
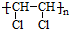
 .
.