题目内容
1.根据要求回答下列问题(1)T0C时,向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生反应.其相关信息如下:图1中t0~t1阶段c(B)未画出;图2中t2、t3、t4改变的条件是温度、压强、催化剂中的一种
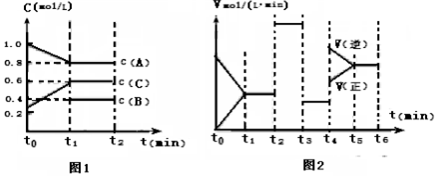
①B的起始物质的量为1mol;t2时刻改变的条件是加催化剂
②图2中各阶段平衡时对应的平衡常数如表所示:
| 时间段 | t1~t2 | t2~t3 | t3~t4 | t5~t6 |
| 平衡常数 | K1 | K2 | K3 | K4 |
③T0C时,该反应的平衡常数是0.84(保留两位小数);维持温度不变,在t1时刻再向该容器中加入1molA,0.5molB,0.3molC,重新达平衡后α(A)=20%
(2)硅是重要的半导体材料.工业上由粗制纯硅的过程如下:
Si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
实验测得上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅(Si的相对原子质量为28)需吸收aKJ热量,则该反应的热化学方程式SiCl4(g)+2H2(g)=Si(s)+4HCl(g)△=+Q/40 KJ/mol.
分析 根据化学反应的速率之比等于化学方程式前的计量系数比来书写方程式,根据影响反应速率和平衡移动的因素来确定改变的条件;图2是在四种不同情况下影响化学的平衡,而影响平衡的因素有:浓度、温度、压强、催化剂;t2~t3和t3~t4这两段平衡是不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应,t2~t3的平衡比原平衡的速率要快,而t3~t4的速率又变慢,则前者应是加催化剂,因为条件只能用一次,t3~t4段为减压;
(1)①反应物的浓度降低,生成物的浓度增大,结合图一可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率之比等于化学方程式前的计量系数比,
该反应的方程式为2A(g)+B(g)?3C(g),据此计算起始量B的物质的量;t2~t3和t3~t4这两段平衡是不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应,t2~t3的平衡比原平衡的速率要快,而t3~t4的速率又变慢,则前者应是加催化剂;
②t1-t2段,平衡常数K1,
t2-t3段,使用催化剂,加快反应,平衡常数不变,K2=K1,
t3-t4段,为降低压强,反应速率降低,平衡不移动,平衡常数不变,K3=K1,
t4-t5段,t5-t6段达到平衡状态,为升高温度,平衡向逆反应方向移动,平衡常数减小;
③t1-t2段,处于平衡状态,c(A)平衡=0.8mol/L,c(B)平衡=0.4mol/L,c(C)平衡=0.6mol/L,
K1=$\frac{{c}^{3}(C)}{{c}^{2}(A)c(B)}$=$\frac{0.{6}^{3}}{0.{8}^{2}×0.4}$=0.84,在t1时刻再向该容器中加入1molA,0.5molB,0.3molC,等比例加入起始量,相当于增大压强,平衡不变,达到相同的平衡状态;
(2)测得每生成1.12kg纯硅(Si的相对原子质量为28)需吸收aKJ热量,结合热化学方程式书写方法,标注物质聚集状态和化学方程式定量关系对应的反应焓变.
解答 解:(1)t2~t3和t3~t4这两段平衡是不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应,
t2~t3的平衡比原平衡的速率要快,而t3~t4的速率又变慢,则前者应是加催化剂,因为条件只能用一次,t3~t4段为减压.
①反应物的浓度降低,生成物的浓度增大,结合图一可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率之比等于化学方程式前的计量系数比,
该反应的方程式为2A(g)+B(g)?3C(g),所以,△c(B)=$\frac{1}{2}$△n(A)=$\frac{1}{2}$×0.2mol/L=0.1mol/L,起始2molA所对应的浓度为1mol/L,则体积应是$\frac{2mol}{1mol/L}$=2L,故B的起始物质的量为n(B)=(0.1mol/L+0.4mol/L)×2L=1mol,
故答案为:1;加催化剂;
②t1-t2段,平衡常数K1,
t2-t3段,使用催化剂,加快反应,平衡常数不变,K2=K1,
t3-t4段,为降低压强,反应速率降低,平衡不移动,平衡常数不变,K3=K1,
t4-t5段,t5-t6段达到平衡状态,为升高温度,平衡向逆反应方向移动,平衡常数减小,
故 K1=K2=K3>K4,
故答案为:>;t2-t4 平衡未移动,从图象知K4是温度升高平衡逆向移动后的平衡常数,所以升温平衡常数变小;
③t1-t2段,处于平衡状态,c(A)平衡=0.8mol/L,c(B)平衡=0.4mol/L,c(C)平衡=0.6mol/L,
K1=$\frac{{c}^{3}(C)}{{c}^{2}(A)c(B)}$=$\frac{0.{6}^{3}}{0.{8}^{2}×0.4}$=0.84,
向一容积为2升的密闭容器中充入2molA、0.6molC和1molB三种气体,维持温度不变,反应达到平衡状态2A(g)+B(g)?3C(g),
在t1时刻再向该容器中加入1molA,0.5molB,0.3molC,等比例加入起始量,相当于增大压强,平衡不变,达到相同的平衡状态,A的转化率不变,依据图象中数据计算α(A)=$\frac{1.0mol/L-0.8mol/L}{1.0mol/L}$×100%=20.0%,
故答案为:0.84; 20%;
(2)测得每生成1.12kg纯硅(Si的相对原子质量为28)需吸收aKJ热量,生成1molSi放热$\frac{aKJ}{\frac{1120g}{28g/mol}}$=$\frac{a}{40}$KJ,反应的热化学方程式为:SiCl4(g)+2H2(g)=Si(s)+4HCl(g)△=+Q/40 KJ/mol,
故答案为:SiCl4(g)+2H2(g)=Si(s)+4HCl(g)△=+Q/40 KJ/mol.
点评 本题以图象的形式考查影响化学反应速率以及化学平衡移动的因素,主要是影响化学反应速率和化学平衡的因素分析、平衡常数计算和影响因素、等效平衡的理解应用、热化学方程式书写等,题目难度中等

 阅读快车系列答案
阅读快车系列答案| X | Y | |
| Z | W |
| A. | X、Y 均能形成不止一种氢化物 | |
| B. | YO 2是一种有毒气体,属于酸性氧化物 | |
| C. | Y 的最简单氢化物比 Z 的稳定性更强 | |
| D. | XW2中各原子最外层均达到 8e-稳定结构 |

| A. | 酯化反应 | B. | 氧化反应 | C. | 加成反应 | D. | 水解反应 |
| A. | 通过化学变化可实现${\;}_{1}^{2}$H与${\;}_{1}^{1}$H的相互转化 | |
| B. | ${\;}_{1}^{2}$H与${\;}_{1}^{1}$H的核外电子排布方式相同,化学性质相同 | |
| C. | ${\;}_{1}^{2}$H与${\;}_{1}^{1}$H核外电子数和中子数均为1 | |
| D. | ${\;}_{1}^{2}$H与H2互为同素异形体 |
| A. | 原子半径:X<W<Z<Y | |
| B. | 简单氢化物的稳定性:X>W>Z | |
| C. | 氢元素与W、X形成的相对分子质量最小的酸分子式为H2WX3 | |
| D. | X与Y形成的两种二元化合物中,阴、阳离子数之比均为1:2 |

| A. | 能跟KOH溶液反应 | B. | 能被氧化 | C. | 能发生加聚反应 | D. | 能使溴水褪色 |
 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$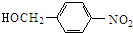 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$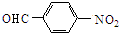 .
. ,名称是乙烯.
,名称是乙烯. ,名称是聚乙烯.
,名称是聚乙烯.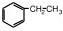 、
、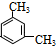 .
. .属于取代反应反应类型.
.属于取代反应反应类型.