题目内容
13.短周期元素W、X、Y、Z的原子序数依次增大,W、Z同主族.X2-与Y+离子的电子层结构相同,Z的单质可用作太阳能也池的光电转换材料.下列说法错误的是( )| A. | 原子半径:X<W<Z<Y | |
| B. | 简单氢化物的稳定性:X>W>Z | |
| C. | 氢元素与W、X形成的相对分子质量最小的酸分子式为H2WX3 | |
| D. | X与Y形成的两种二元化合物中,阴、阳离子数之比均为1:2 |
分析 短周期元素W、X、Y、Z的原子序数依次增大,Z的单质可用作太阳能也池的光电转换材料,Z为Si,W、Z同主族,W为C;X2-与Y+离子的电子层结构相同,则X为O,Y为Na,然后结合元素周期律及元素化合物知识来解答.
解答 解:由上述分析可知,W为C,X为O,Y为Na,Z为Si,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:X<W<Z<Y,故A正确;
B.非金属性越强,对应氢化物越稳定,则简单氢化物的稳定性:X>W>Z,故B正确;
C.氢元素与W、X形成的相对分子质量最小的酸为HCOOH,分子式为分子式为H2WX2,故C错误;
D.X与Y形成的两种二元化合物为Na2O或Na2O2,阴、阳离子数之比均为1:2,故D正确;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识、元素的位置、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
3.关于下列各装置图的叙述不正确的是( )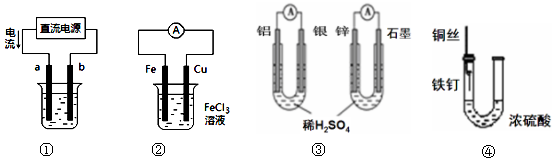

| A. | 用装置①精炼铜,则a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ | |
| C. | 图③两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
4.下列叙述正确的是( )
| A. | 在中和热测定实验中,将碱缓慢倒入酸中,以确保酸碱充分反应 | |
| B. | 为除去蛋白质溶液中混有的(NH4)2SO4,将混合物装入半透膜袋,并放入流动的蒸馏水中 | |
| C. | 用排水集气法收集气体,能验证铜与稀硝酸的反应产物是NO | |
| D. | 向硝酸银溶液中先滴加少量氯化钠溶液,再加少量硫化钾溶液,试管中先有白色沉淀,后有黑色沉淀,则AgCl的溶解度大于Ag2S |
1.根据要求回答下列问题
(1)T0C时,向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生反应.其相关信息如下:图1中t0~t1阶段c(B)未画出;图2中t2、t3、t4改变的条件是温度、压强、催化剂中的一种
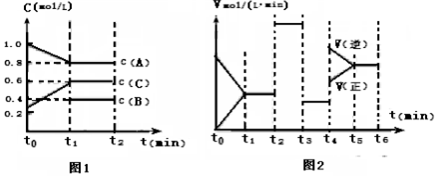
①B的起始物质的量为1mol;t2时刻改变的条件是加催化剂
②图2中各阶段平衡时对应的平衡常数如表所示:
K2> K4(填“>或<或.=”);其理由是t2-t4 平衡未移动,从图象知K4是温度升高平衡逆向移动后的常数,所以变小
③T0C时,该反应的平衡常数是0.84(保留两位小数);维持温度不变,在t1时刻再向该容器中加入1molA,0.5molB,0.3molC,重新达平衡后α(A)=20%
(2)硅是重要的半导体材料.工业上由粗制纯硅的过程如下:
Si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
实验测得上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅(Si的相对原子质量为28)需吸收aKJ热量,则该反应的热化学方程式SiCl4(g)+2H2(g)=Si(s)+4HCl(g)△=+Q/40 KJ/mol.
(1)T0C时,向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生反应.其相关信息如下:图1中t0~t1阶段c(B)未画出;图2中t2、t3、t4改变的条件是温度、压强、催化剂中的一种

①B的起始物质的量为1mol;t2时刻改变的条件是加催化剂
②图2中各阶段平衡时对应的平衡常数如表所示:
| 时间段 | t1~t2 | t2~t3 | t3~t4 | t5~t6 |
| 平衡常数 | K1 | K2 | K3 | K4 |
③T0C时,该反应的平衡常数是0.84(保留两位小数);维持温度不变,在t1时刻再向该容器中加入1molA,0.5molB,0.3molC,重新达平衡后α(A)=20%
(2)硅是重要的半导体材料.工业上由粗制纯硅的过程如下:
Si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
实验测得上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅(Si的相对原子质量为28)需吸收aKJ热量,则该反应的热化学方程式SiCl4(g)+2H2(g)=Si(s)+4HCl(g)△=+Q/40 KJ/mol.
8.下列所示装置正确且能完成相关实验的是( )
| A. |  用所示装置制取并观察Fe(OH)2 | |
| B. |  用所示装置制取金属锰 | |
| C. | 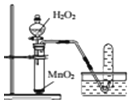 用所示装置制取干燥的O2 | |
| D. | 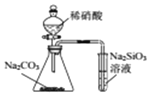 用所示装置比较N、C、Si的非金属性强弱 |
18.中华民族有着光辉灿烂的发明史,下列发明创造的主要原理不涉及化学变化的是( )
| A. | 黑火药的使用 | B. | 用铁矿石炼铁 | ||
| C. | 打磨磁石制备指南针 | D. | 造纸术的使用 |
5.某有机物的结构简式如图所示,关于该物质的叙述错误的是( )
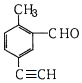

| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 与新制氢氧化铜悬浊液加热煮沸产生砖红色沉淀 | |
| C. | 1mol该物质和H2反应,最多消耗5molH2 | |
| D. | 苯环上的一氯代物有3种 |
2.除去FeCl2溶液中的FeCl3所需试剂是( )
| A. | Cl2 | B. | Cu | C. | Fe | D. | NaOH |