题目内容
10.下列有机物在一定条件下自身分子间能发生缩聚反应,而在适宜的条件下分子内又能形成环状结构的是( )| A. | 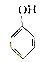 | B. | CH2═CH-Cl | ||
| C. | 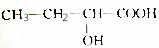 | D. | HO(CH2)4COOH |
分析 自身分子间能发生缩聚反应,可能此有机物既存在羧基又存在羟基,或者是既存在氨基又存在羧基;在适宜的条件下分子内又能形成环状结构,可生成环酯等,以此来解答.
解答 解:A.苯酚不能自身发生缩聚反应,故A错误;
B.CH2=CHCl含有碳碳双键,能发生加聚反应,不能发生缩聚反应,故B错误;
C.含-OH、-COOH可发生缩聚反应,且可生成环酯,故C正确;
D.含-OH、-COOH可发生缩聚反应,且可生成环酯,故D正确,
故选CD.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力及有机反应的考查,题目难度不大.

练习册系列答案
相关题目
20.短周期(前三周期)元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述不正确的是( )
| A. | X元素可以与W元素形成WX2和WX3两种化合物 | |
| B. | Y元素的单质一定条件下可以与O2、N2、CO2反应 | |
| C. | Z原子的最外层电子数为4,形成化合物时一般为+4价 | |
| D. | X与Y、Z与W都属于同一周期 |
18.能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是( )
| A. | 铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液 | |
| B. | 铜锌合金在潮湿空气中发生电化学腐蚀 | |
| C. | 用铜片作阴、阳电极,电解硫酸钠溶液 | |
| D. | 用铜片作阴、阳电极,电解硫酸铜溶液 |
15.下列离子方程式正确的是( )
| A. | 碳酸镁固体与稀硫酸反应:MgCO3+2H++2SO42-═MgSO4+CO2↑+H2O | |
| B. | 碳酸钠溶液与足量氯水反应:CO32-+Cl2═CO2↑+Cl-+ClO- | |
| C. | 碳酸氢铵溶液中加足量氢氧化钡溶液:NH4++HCO3-+2OH-═CO32-+NH3•H2O+H2O | |
| D. | 酸性条件下KClO3和草酸(H2C2O4)生成高效消毒杀菌剂ClO2: 2ClO3-+H2C2O4+2H+═2ClO2↑+2CO2↑+2H2O |
2.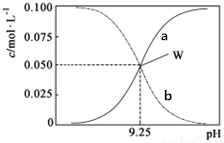 25℃时,将氨水与氯化铵溶液混合得到c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
 25℃时,将氨水与氯化铵溶液混合得到c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )| A. | 曲线a代表c(NH3•H2O),曲线b代表(NH4+) | |
| B. | 25℃时,NH3•H2O的电离平衡常数Kb=10-4.75 | |
| C. | pH=10.5溶液中c(Cl-)+c(OH-)+c(NH3•H2O)<0.1 mol•L-1 | |
| D. | pH=9.5溶液中c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
19.三氟化氮(NF3)是无色无味的气体,它可由氨气和氟气反应得到,反应的化学方程式为4NH3+3F2═NF3+3NH4F.下列有关NF3的叙述不正确的是( )
| A. | NF3中N呈+3价 | B. | NF3是共价化合物 | ||
| C. | NF3的氧化性比F2强 | D. | NF3分子呈三角锥形 |
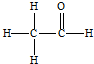 ,其PMR谱中有2个信号峰,其强度之比为3:1.
,其PMR谱中有2个信号峰,其强度之比为3:1.