题目内容
18.能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是( )| A. | 铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液 | |
| B. | 铜锌合金在潮湿空气中发生电化学腐蚀 | |
| C. | 用铜片作阴、阳电极,电解硫酸钠溶液 | |
| D. | 用铜片作阴、阳电极,电解硫酸铜溶液 |
分析 金属铜和水之间发生的反应是非自发的氧化还原反应,应设计成电解池,根据电解池的工作原理结合反应来选择电极材料以及电解质溶液.
解答 解:金属铜和水之间发生的反应是非自发的氧化还原反应,应设计成电解池,在反应Cu+2H2O═Cu(OH)2↓+H2↑中,失电子的是金属铜,所以必须选择金属铜作阳极材料,其他导电的物质做阴极材料即可,在阴极上应该是水中的氢离子得电子的反应,注意阳离子是氢离子得电子,电解质溶液中其他离子的得电子能力要比氢离子弱,可以选择硫酸钠等来做电解质,
A.原电池原理不能实现该非自发的氧化还原反应,故A错误;
B.铜锌合金在潮湿的空气中发生电化学腐蚀时,金属锌被腐蚀,铜被保护,故B错误;
C.用铜片作阴、阳电极,电解硫酸钠溶液,可以实现该反应的发生,故C正确;
D.以铜为电极电解硫酸铜溶液的原理是在阴极上铜离子比氢离子易得电子,得电子后析出金属铜,不会产生氢气,故D错误;
故选C.
点评 本题是一道电解池工作原理知识的实验设计题,考查学生分析和解决问题的能力,注意离子的放电顺序,难度适中.

练习册系列答案
相关题目
9.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+ K+ OH- Cl- | B. | Na+ Cu2+ SO42- NO3- | ||
| C. | K+ Na+ SO42- Cl- | D. | Ba2+ CO32- NO3- K+ |
6.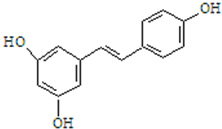 白藜芦醇的结构简式如图.它广泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性.下列有关白藜芦醇的说法正确的是( )
白藜芦醇的结构简式如图.它广泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性.下列有关白藜芦醇的说法正确的是( )
 白藜芦醇的结构简式如图.它广泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性.下列有关白藜芦醇的说法正确的是( )
白藜芦醇的结构简式如图.它广泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性.下列有关白藜芦醇的说法正确的是( )| A. | 该有机物属于醇类 | |
| B. | 1mol该有机物与H2加成时最多消耗1mol H2 | |
| C. | 1mol该有机物与Br2反应时最多消耗6mol Br2 | |
| D. | 1mol该有机物最多消耗3mol NaOH |
13.参考下列(a)~(c)项回答问题:
(a)皂化值是使1g油脂皂化所需要的KOH的毫克数.
(b)碘值是使100g油脂加成碘的克数.
(c)各种油脂的皂化值、碘值列表如下:
(1)单纯由(C17H33COO)3C3H5(相对分子质量884)形成的油,皂化值是190
(2)在横线上填入适当的词句:
亚麻仁油比花生油所含的碳碳双键多,黄油比牛油的平均相对分子质量小.硬化大豆油的碘值小的原因是硬化大豆油已经过硬化处理,含碳碳双键很少,所以碘值很小.
(3)为使碘值为180的鱼油100g硬化所需要的H2的体积为15.9升(标准状况下)?
(4)结构简式为 的酯,若皂化值为430,求n为4.
的酯,若皂化值为430,求n为4.
(a)皂化值是使1g油脂皂化所需要的KOH的毫克数.
(b)碘值是使100g油脂加成碘的克数.
(c)各种油脂的皂化值、碘值列表如下:
| 花生油 | 亚麻仁油 | 牛油 | 黄油 | 硬化大豆油 | 大豆油 | |
| 皂化值 | 190 | 180 | 195 | 226 | 193 | 193 |
| 碘值 | 90 | 182 | 38 | 38 | 5 | 126 |
(2)在横线上填入适当的词句:
亚麻仁油比花生油所含的碳碳双键多,黄油比牛油的平均相对分子质量小.硬化大豆油的碘值小的原因是硬化大豆油已经过硬化处理,含碳碳双键很少,所以碘值很小.
(3)为使碘值为180的鱼油100g硬化所需要的H2的体积为15.9升(标准状况下)?
(4)结构简式为
 的酯,若皂化值为430,求n为4.
的酯,若皂化值为430,求n为4.
3.下列与反应原理相关的叙述不正确的是( )
| A. | 装置Ⅰ中不可能发生如下反应:Fe+2Fe3+=3Fe2+ | |
| B. | 装置Ⅱ在反应结束时溶液中存在Fe2+ | |
| C. | 装置Ⅰ的溶液若换为稀硝酸,则腐蚀过程与原装置不同 | |
| D. | 装置Ⅱ中的铁丝能发生电化学腐蚀 |
10.下列有机物在一定条件下自身分子间能发生缩聚反应,而在适宜的条件下分子内又能形成环状结构的是( )
| A. | 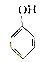 | B. | CH2═CH-Cl | ||
| C. | 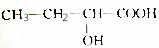 | D. | HO(CH2)4COOH |
7.下列物质中含有两种官能团的是( )
| A. | 四氯甲烷(CCl4) | B. | 甘油 | C. | 乙烷(CH3CH3) | D. | 氯乙烯(CH2═CHCl) |