题目内容
20.短周期(前三周期)元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述不正确的是( )| A. | X元素可以与W元素形成WX2和WX3两种化合物 | |
| B. | Y元素的单质一定条件下可以与O2、N2、CO2反应 | |
| C. | Z原子的最外层电子数为4,形成化合物时一般为+4价 | |
| D. | X与Y、Z与W都属于同一周期 |
分析 短周期(前三周期)元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,则X有2个电子层,最外层电子数为6,故X为O元素;Y原子的最外层只有2个电子,Y应为第三周期的Mg元素;Z单质可制成半导体材料,则Z为Si元素;W与X属于同一主族,W为S,然后结合元素化合物知识来解答.
解答 解:短周期(前三周期)元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,则X有2个电子层,最外层电子数为6,故X为O元素;Y原子的最外层只有2个电子,Y应为第三周期的Mg元素;Z单质可制成半导体材料,则Z为Si元素;W与X属于同一主族,W为S,
A.X元素可以与W元素形成SO2和SO3两种化合物,故A正确;
B.Y元素的单质一定条件下可以与O2、N2、CO2反应,分别生成MgO、Mg3N2、MgO和C,故B正确;
C.Z原子的最外层电子数为4,形成化合物时一般为+4价,如SiO2、SiCl4中Si为+4价,故C正确;
D.由上述分析可知,X为第二周期元素,Y、Z、W均在第三周期,故D错误;
故选D.
点评 本题考查原子结构和周期律的应用,为高频考点,把握X原子的最外层电子数是其电子层数的3倍推断X为O元素为解答的关键,侧重分析与应用能力的考查,注意周期律及元素化合物知识运用,题目难度不大.

练习册系列答案
相关题目
10.下列化学用语表示正确的是( )
| A. | NH3分子的电子式: | B. | CH4分子的比例模型: | ||
| C. | F原子的结构示意图: | D. | N2的结构式:N≡N |
11.下列化学用语表达正确的是( )
| A. | 次氯酸电子式: | B. | 氟化氢的电子式: | ||
| C. | F原子结构示意图: | D. | CO2分子的球棍模型: |
15.有关乙烯及其相关有机物的结构和性质,下列说法正确的是( )
| A. | 乙烯使酸性高锰酸钾褪色的原理和使溴水褪色的原理相同 | |
| B. | 乙烯不能合成高分子化合物 | |
| C. | 工业制备乙烯通常通过石油的裂解 | |
| D. | 聚乙烯能使溴水褪色 |
5.下列说法正确的是 ( )
| A. | HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子 | |
| B. | NH3和CH4的空间构型相似 | |
| C. | BF3与 都是平面型分子 都是平面型分子 | |
| D. | CO2和H2O都是直线型分子 |
12.1919年,Langmuir提出等电子体的概念:原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征.下列各对粒子中,空间结构相似的是( )
| A. | CS2与NO2 | B. | SO2与N2O | C. | SO2与O3 | D. | PCl3与BF3 |
9.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+ K+ OH- Cl- | B. | Na+ Cu2+ SO42- NO3- | ||
| C. | K+ Na+ SO42- Cl- | D. | Ba2+ CO32- NO3- K+ |
10.下列有机物在一定条件下自身分子间能发生缩聚反应,而在适宜的条件下分子内又能形成环状结构的是( )
| A. | 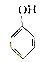 | B. | CH2═CH-Cl | ||
| C. | 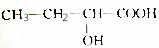 | D. | HO(CH2)4COOH |