题目内容
浓H2SO4 密度1.84g/mL,物质的量浓度为18.4mol/L,质量分数为98%,取10mL浓H2SO4和amL水混合得物质的量浓度为Cmol/L,质量分数为b%.下列组合正确的是( )
(1)若b=49 则a=18.4 C>9.2 (2)若b=49 则a=18.4 C<9.2
(3)若C=9.2 则a>10 b>49% (4)若C=9.2 则a>10 b<49%
(1)若b=49 则a=18.4 C>9.2 (2)若b=49 则a=18.4 C<9.2
(3)若C=9.2 则a>10 b>49% (4)若C=9.2 则a>10 b<49%
| A、(1)(3) |
| B、(1)(4) |
| C、(2)(3) |
| D、(2)(4) |
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:若b=49,根据稀释过程中溶质硫酸的质量不变列方程计算a,结合c=
mol/L计算49%的硫酸的浓度;
若C=9.2,根据稀释定律计算稀释后溶液的体积,硫酸的浓度越大,密度越小,确定混合后溶液的质量与10mL原浓硫酸质量关系,进而确定稀释后溶液质量分数,根据稀释过程中溶质硫酸的质量不变列不等式计算a.
| 1000ρω |
| M |
若C=9.2,根据稀释定律计算稀释后溶液的体积,硫酸的浓度越大,密度越小,确定混合后溶液的质量与10mL原浓硫酸质量关系,进而确定稀释后溶液质量分数,根据稀释过程中溶质硫酸的质量不变列不等式计算a.
解答:
解:若b=49,稀释过程中溶质硫酸的质量不变,则:10mL×1.84g/mL×98g%=(10mL×1.84g/mL+amL×1g/mL)×49%,解得a=18.4,令稀释后的密度为dg/mL,则d<1.84,稀硫酸的物质的量浓度C=
mol/L<9.2mol/L;
若C=9.2,根据稀释定律,可知稀释后溶液的体积为
=20mL,硫酸的浓度越大,密度越小,故稀释后溶液的质量小于原浓硫酸质量的2倍,稀释过程硫酸的质量不变,故稀释后硫酸的质量分数大于49%,即b>49%,稀释过程中溶质硫酸的质量不变,则:10mL×1.84g/mL×98g%<(10mL×1.84g/mL+amL×1g/mL)×49%,解得a>18.4;
故选C.
| 1000d×49% |
| 98 |
若C=9.2,根据稀释定律,可知稀释后溶液的体积为
| 10mL×18.4mol/L |
| 9.2mol/L |
故选C.
点评:本题考查溶液浓度的有关计算,题目难度中等,注意掌握物质的量浓度与质量分数之间的关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
把2.5mol A和2.5mol B混合盛入容积为2L的密闭容器里,发生如下反应:3A(g)+B(g)?x C(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2mol?L-1?s-1,同时生成1mol D,下列叙述中错误的是( )
| A、达到平衡状态时A的转化率为50% |
| B、x=4 |
| C、达到平衡状态时容器内气体的压强与起始时压强比为6:5 |
| D、5s内B的反应速率v(B)=0.05 mol/(L?s) |
下列离子方程式书写不正确的是( )
| A、FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| B、澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-=CaCO3↓+H2O |
| C、FeS固体放人稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ |
| D、AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3-↓ |
只用水不能鉴别的一组物质是( )
| A、乙醇和乙酸 |
| B、乙酸乙酯和乙醇 |
| C、苯和四氯化碳 |
| D、苯和汽油 |
下列说法正确的是( )
| A、维生素C有较强的还原性,可将I2、Fe3+还原 |
| B、使用青霉素时,不用进行皮试可直接静脉注射 |
| C、酒精、双氧水、次氯酸、臭氧均可用于餐具杀菌消毒 |
| D、胃酸过多的病人都可以服用氢氧化钠、氢氧化铝、碳酸钠等中和胃酸的药 |
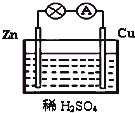 如图为原电池的示意图.请回答:
如图为原电池的示意图.请回答:


