题目内容
高锰酸钾在不同的条件下发生的反应如下:
MnO4-+5e-+8H+═Mn2++4H2O ①
MnO4-+3e-+2H2O═MnO2↓+4OH- ②
MnO4-+e-═MnO42-(溶液绿色) ③
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的 影响.
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为 → .
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列说法正确的是
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3:2,完成下列化学方程式(横线上填系数,括号内填物质):
① KMnO4+ K2S+ ═ K2MnO4+ K2SO4+ S↓+ .
②若生成6.4g单质硫,反应过程中转移电子的物质的量为 .
MnO4-+5e-+8H+═Mn2++4H2O ①
MnO4-+3e-+2H2O═MnO2↓+4OH- ②
MnO4-+e-═MnO42-(溶液绿色) ③
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列说法正确的是
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3:2,完成下列化学方程式(横线上填系数,括号内填物质):
①
②若生成6.4g单质硫,反应过程中转移电子的物质的量为
考点:氧化性、还原性强弱的比较,氧化还原反应的电子转移数目计算,氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:(1)根据离子颜色结合溶液酸碱性判断;
(2)得电子化合价降低的微粒发生还原反应;
(3)同一化学反应中氧化剂的氧化性大于还原产物的氧化性;
(4)根据氧化还原反应中得失电子数相等配平方程式,并注意也要遵循原子守恒;根据硫单质和转移电子之间的关系式计算转移电子数.
(2)得电子化合价降低的微粒发生还原反应;
(3)同一化学反应中氧化剂的氧化性大于还原产物的氧化性;
(4)根据氧化还原反应中得失电子数相等配平方程式,并注意也要遵循原子守恒;根据硫单质和转移电子之间的关系式计算转移电子数.
解答:
解:(1)根据反应式知,溶液的酸碱性不同溶液的颜色不同,所以溶液的颜色受溶液酸碱性的影响,故答案为:酸碱性;
(2)二氧化硫含有还原性,酸性条件下,高锰酸根离子得电子生成二价锰离子,所以高锰酸根离子有强氧化性,所以还原反应的过程为MnO4-→Mn2+,
故答案为:MnO4-;Mn2+;
(3)同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性,将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色,说明PbO2氧化二价锰离子生成高锰酸根离子,所以PbO2作氧化剂,高锰酸根离子是氧化产物,所以PbO2的氧化性大于高锰酸根离子,故选a;
(4)该反应中,高锰酸钾是氧化剂,一个高锰酸钾化学式得5个电子,硫化钾是还原剂,K2SO4和S的物质的量之比为3:2,所以硫化钾生成硫酸钾和硫单质失去的电子数是28个电子,所以得失电子的最小公倍数是140,所以高锰酸钾的计量数是25,硫化钾的计量数是5,其它元素根据原子个数相等配平,所以方程式为:28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+3S↓+12H2O;

设转移电子数是x.
28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O 转移电子
2mol 28NA
x=2.8NA,
故答案为:28;5;24KOH;28;3;2;12H2O;2.8NA.
(2)二氧化硫含有还原性,酸性条件下,高锰酸根离子得电子生成二价锰离子,所以高锰酸根离子有强氧化性,所以还原反应的过程为MnO4-→Mn2+,
故答案为:MnO4-;Mn2+;
(3)同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性,将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色,说明PbO2氧化二价锰离子生成高锰酸根离子,所以PbO2作氧化剂,高锰酸根离子是氧化产物,所以PbO2的氧化性大于高锰酸根离子,故选a;
(4)该反应中,高锰酸钾是氧化剂,一个高锰酸钾化学式得5个电子,硫化钾是还原剂,K2SO4和S的物质的量之比为3:2,所以硫化钾生成硫酸钾和硫单质失去的电子数是28个电子,所以得失电子的最小公倍数是140,所以高锰酸钾的计量数是25,硫化钾的计量数是5,其它元素根据原子个数相等配平,所以方程式为:28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+3S↓+12H2O;

设转移电子数是x.
28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O 转移电子
2mol 28NA
| 6.4g |
| 32g/mol |
故答案为:28;5;24KOH;28;3;2;12H2O;2.8NA.
点评:本题考查了有关物质的量的计算、氧化性和还原性的判断等知识点,难度不大,明确氧化性和还原性强弱的判断方法.

练习册系列答案
相关题目
浓H2SO4 密度1.84g/mL,物质的量浓度为18.4mol/L,质量分数为98%,取10mL浓H2SO4和amL水混合得物质的量浓度为Cmol/L,质量分数为b%.下列组合正确的是( )
(1)若b=49 则a=18.4 C>9.2 (2)若b=49 则a=18.4 C<9.2
(3)若C=9.2 则a>10 b>49% (4)若C=9.2 则a>10 b<49%
(1)若b=49 则a=18.4 C>9.2 (2)若b=49 则a=18.4 C<9.2
(3)若C=9.2 则a>10 b>49% (4)若C=9.2 则a>10 b<49%
| A、(1)(3) |
| B、(1)(4) |
| C、(2)(3) |
| D、(2)(4) |
下列离子方程式正确的是( )
| A、稀硝酸中加入过量铁粉:Fe+NO3-+4 H+═Fe3++NO↑+2 H2O |
| B、向碘化亚铁溶液中通少量氯气:Cl2+2Fe2+═2Fe3++2Cl- |
| C、工业刻蚀印刷电路板:2 Fe3++Cu═2 Fe2++Cu2+ |
| D、氢氧化铁溶于氢碘酸:Fe(OH)3+3 H+═Fe3++3 H2O |

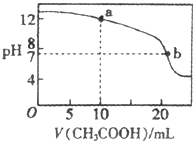 常温下有下列四种溶液:
常温下有下列四种溶液: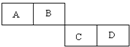 A、B、C、D四种短周期元素在周期表中的相对位置如图所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如图所示,A的单质与水蒸气反应可以制取水煤气.