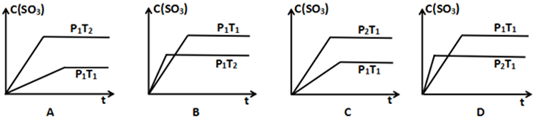
题目内容
12. FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题:(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示):2Fe3++Fe=3Fe2+.
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3.
①若酸性FeCl2废液中c(Fe2+)=0.2mol•L-1,c(Fe3+)=0.01mol•L-1,c(Cl-)=0.53mol•L-1,则该溶液的pH约为1.
②完成NaClO3氧化FeCl2的离子方程式:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)FeCl3在溶液中分三步水解:
Fe3++H2O?Fe(OH)2++H+K1
Fe(OH)2++H2O?Fe(OH)2++H+K2
Fe(OH)2++H2O?Fe(OH)3+H+K3
①则Fe(OH)3的沉淀溶解平衡常数Ksp用Kw(水的离子积)、K1、K2、K3表示为:Ksp=$\frac{Kw3}{K1•K2•K3}$.
②通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为:xFe3++yH2O?Fex(OH)y(3x-y)++yH+.欲使平衡正向移动可采用的方法是(填序号)bd.
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
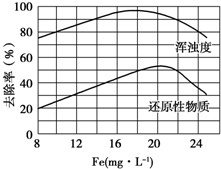
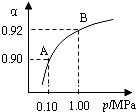
(4)扬州某污水处理厂用聚合氯化铁净化污水的结果如图所示.由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg•L-1)表示]的最佳范围约为18-20mg•L-1.
分析 (1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用,钢铁设备中的Fe会与铁离子反应生成亚铁离子;
(2)①根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),据此溶液中氢离子的浓度,再根据pH=-lgc(H+)计算;
②氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3;
(3)①根据平衡常数表达式来确定它们之间的关系;
②控制条件使平衡正向移动,水解为吸热反应,所以降温平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,平衡正向移动;
(4)由图象可知,聚合氯化铁的浓度在18~20 mg•L-1时,去除率达到最大值,污水的浑浊度减小.
解答 解:(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用,钢铁设备中的Fe会与铁离子反应生成亚铁离子,离子方程式是:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(2)①根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),则c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-1mol•L-1,则溶液pH=-lg1.0×10-1=1,
故答案为:2;
②氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3,配平后离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)①化学平衡常数等于各个生成物平衡浓度系数次幂之积和各个反应物平衡浓度系数次幂之积的比值,得到常数之间的关系是Ksp=$\frac{Kw3}{K1•K2•K3}$,故答案为:Ksp=$\frac{Kw3}{K1•K2•K3}$;
②控制条件使平衡正向移动,使平衡正向移动,因为水解为吸热反应,所以降温,平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,故选bd;
故答案为:bd;
(4)由图象可知,聚合氯化铁的浓度在18~20 mg•L-1时,去除率达到最大值,污水的浑浊度减小,
故答案为:18~20.
点评 本题考查铁的化合物性质的应用、氧化还原反应方程式的配平、对图象的分析能力、平衡移动影响因素等,需要学生具备扎实的基础与灵活运用难度,难度中等.

 口算题天天练系列答案
口算题天天练系列答案| A. | 烧碱、氧气、碘酒 | B. | 小苏打、石灰水、二氧化硫 | ||
| C. | 干冰、铁、氯化氢 | D. | 空气、氮气、胆矾 |
| 元素编号 | 元素性质或原子结构 |
| T | 最高正价与最低负价的代数和为4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 最高正价是+7价 |
(2)X的一种同位素可用于测定文物年代,该同位素为614C (用原子符号表示).
(3)Z单质的电子式为
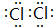 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列能证明这一事实的是d(填字母)
a.常温下,Z单质为气体,T单质为固体 b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高 d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生反应的化学方程式为HCl+NH3=NH4Cl,产物中含有的化学键类型为离子键、共价键.
| A. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| B. | 活化分子间的碰撞一定能导致化学键断裂 | |
| C. | 在FeCl3+3KSCN═Fe(SCN)3+3KCl平衡体系中,加入KCl固体,平衡逆向移动 | |
| D. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向熵增的方向转变的倾向 |
| A. | CO2 | B. | NH3 | C. | H2O | D. | SO2 |
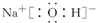 .
. .
. 工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则
工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则