题目内容
16. 如表为元素周期表的一部分.
如表为元素周期表的一部分.| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期、第ⅦA族.
(2)表中元素原子半径最大的是(填元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)沸点:H2Y>H2S(填“>”或“=”或“<”),理由是H2O分子间有氢键,氢键比分子间作用力强.
(5)Y2和Y3互为同素异形体(填“同位素”或“同分异构体”或“同素异形体”).
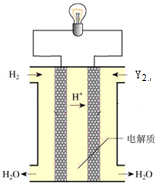
(6)其中单质Y2可用做如图所示装置(燃料电池)的氧化剂,请写出Y2在酸性电解质溶液中发生的电极反应方程式O2+4e-+4H+=2H2O.
分析 由元素在周期表的位置可知,X为Si,Y为O,Z为Cl,
(1)Z为Cl,质子数为17,电子结构有3个电子层,最外层电子数为7;
(2)电子层越多,原子半径越大;同周期从左向右原子半径减小;
(3)Y元素的非金属性比S元素的非金属性强,可利用单质之间的置换反应、氢化物稳定性比较;
(4)水中含氢键沸点高;
(5)氧气与臭氧均为氧元素的单质;
(6)O2在酸性电解质溶液中得到电子生成水,发生还原反应.
解答 解:由元素在周期表的位置可知,X为Si,Y为O,Z为Cl,
(1)Z为Cl,位于周期表中第三周期、第ⅦA族,故答案为:第三周期、第ⅦA族;
(2)电子层越多,原子半径越大;同周期从左向右原子半径减小,则上述元素中Si的原子半径最大,故答案为:Si;
(3)a.Y单质与H2S溶液反应,溶液变浑浊,则Y的得到电子能力强,Y的非金属性强化,故a选;
b.在氧化还原反应中,1molY单质比1molS得电子多,得电子多少不能比较非金属性,故b不选;
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高,可知Y的氢化物稳定,则Y的非金属性强,故c选;
故答案为:ac;
(4)沸点:H2Y>H2S,理由是H2O分子间有氢键,氢键比分子间作用力强,
故答案为:>;H2O分子间有氢键,氢键比分子间作用力强;
(5)Y2和Y3互为同素异形体,故答案为:同素异形体;
(6)O2在酸性电解质溶液中得到电子生成水,发生还原反应,正极反应为O2+4e-+4H+=2H2O,
故答案为:O2+4e-+4H+=2H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案
相关题目
7.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA | |
| D. | 通常状况下,NA 个CO2分子占有的体积为22.4L |
4.下列说法正确的是( )
| A. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| B. | 活化分子间的碰撞一定能导致化学键断裂 | |
| C. | 在FeCl3+3KSCN═Fe(SCN)3+3KCl平衡体系中,加入KCl固体,平衡逆向移动 | |
| D. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向熵增的方向转变的倾向 |
11.甲醇是21世纪应用最广泛的清洁燃料之一,通过下列反应可以制备甲醇:CO ( g )+2H2 ( g )?CH3OH ( l )△H
(1)已知:
计算上述反应的△H=-128.1kJ•mol-1.
(2)在容积可变的密闭容器中充入1mol CO ( g ) 和2molH2 ( g )生成CH3OH( g ),H2的平衡转化率随温度(T)、压强(P)的变化如图1所示.
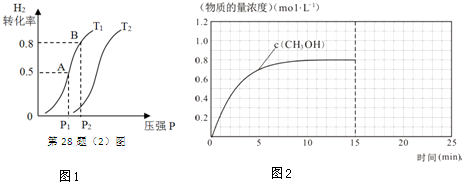
①该反应的△S<0,图中的T1<T2(填“<”、“>”或“=”).
②当达到平衡状态A 时,容器的体积为2L,此时该反应的平衡常数为4,若达到平衡状态B 时,则容器的体积V(B)=0.4L.
③在该容器中,下列措施可增加甲醇产率的是B.
A.升高温度 B.从平衡体系中及时分离CH3OH
C.充入He D.再充入0.5mol CO和1mol H2
(3)在容积固定为2L的密闭容器中充入2molCO( g )和6molH2( g )生成CH3OH( g ),反应时间与物质的量浓度的关系如图2所示,则前10分钟内,氢气的平均反应速率为0.16mol•L-1•min-1;若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图2中画出15-25分钟c (CO)的变化曲线.
(1)已知:
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
(2)在容积可变的密闭容器中充入1mol CO ( g ) 和2molH2 ( g )生成CH3OH( g ),H2的平衡转化率随温度(T)、压强(P)的变化如图1所示.

①该反应的△S<0,图中的T1<T2(填“<”、“>”或“=”).
②当达到平衡状态A 时,容器的体积为2L,此时该反应的平衡常数为4,若达到平衡状态B 时,则容器的体积V(B)=0.4L.
③在该容器中,下列措施可增加甲醇产率的是B.
A.升高温度 B.从平衡体系中及时分离CH3OH
C.充入He D.再充入0.5mol CO和1mol H2
(3)在容积固定为2L的密闭容器中充入2molCO( g )和6molH2( g )生成CH3OH( g ),反应时间与物质的量浓度的关系如图2所示,则前10分钟内,氢气的平均反应速率为0.16mol•L-1•min-1;若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图2中画出15-25分钟c (CO)的变化曲线.
8.如图为元素周期表的一部分.
回答下列问题
(1)Z元素在周期表中的位置为第三周期、第ⅦA族.
(2)表中元素原子半径最大的是(填元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
(5)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,
联氨分子的电子式为① ,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O .
,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O .
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期、第ⅦA族.
(2)表中元素原子半径最大的是(填元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
(5)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,
联氨分子的电子式为①
 ,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O .
,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O .
5.误服重金属盐使人中毒,应及时采用哪种措施救助?( )
| A. | 喝大量冷开水 | B. | 喝大量食盐水 | ||
| C. | 喝大量牛奶 | D. | 注射大量葡萄糖水 |
6.在2A+B?3C+4D中,表示该反应速率最快的是( )
| A. | υ(A)=0.5mol•L-1•S-1 | B. | υ(B)=0.3 mol•L-1•S-1 | ||
| C. | υ(C)=0.8mol•L-1•S-1 | D. | υ(D)=1 mol•L-1•S-1 |
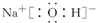 .
. .
.