题目内容
6.在一定条件下,反应A(g)+B(g)?C(g)(正反应为放热反应)达到平衡后,根据下列图象判断: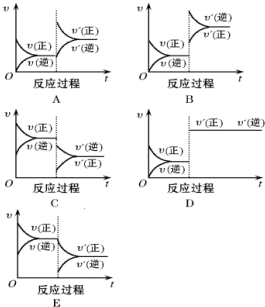
(1)升温,达到新平衡的是B(填图象对应的序号,下同).新平衡中C的体积分数减小(填“增大”、“减小”、“不变”,下同).
(2)降压,达到新平衡的是C,A的转化率减小.
(3)减少C的量,达到新平衡的是E.
(4)增加A的量,此时B的转化率增大.
分析 该反应正反应前后是一个气体体积减小的放热反应;
(1)升高温度正逆反应速率都增大,但平衡逆向移动;
(2)降压,正逆反应速率都减小,平衡逆向移动;
(3)减小C的量,改变条件瞬间正反应速率不变、逆反应速率减小,平衡正向移动;
(4)增加A的量,改变条件瞬间,正反应速率增大、逆反应速率不变,平衡正向移动.
解答 解:该反应正反应前后是一个气体体积减小的放热反应;
(1)升高温度正逆反应速率都增大,但平衡逆向移动,随着反应进行逆反应速率减小、正反应速率增大,达到新的平衡时C体积分数减小,
故答案为:B;减小;
(2)降压,正逆反应速率都减小,平衡逆向移动,随着反应进行逆反应速率减小、正反应速率增大,达到新的平衡时A的转化率减小,
故答案为:C;减小;
(3)减小C的量,改变条件瞬间,正反应速率不变、逆反应速率减小,平衡正向移动,随着反应进行正反应速率减小、逆反应速率增大,
故答案为:E;
(4)增加A的量,改变条件瞬间,正反应速率增大、逆反应速率不变,平衡正向移动,随着反应进行,正反应速率减小、逆反应速率增大,B的转化率增大,
故答案为:增大.
点评 本题考查外界条件对化学平衡移动影响,为高频考点,正确理解外界条件对化学反应速率、化学平衡移动影响原理是解本题关键,注意:改变浓度瞬间,曲线与原曲线有相交点,如果改变的是催化剂,改变条件后反应速率曲线为直线,题目难度不大.

练习册系列答案
相关题目
17.在不引入新杂质的情况下,分离FeCl3、KCl、BaSO4的混合物,应选用的一组试剂是( )
| A. | 水、氢氧化钾溶液、稀盐酸 | B. | 水、氢氧化钠溶液、稀盐酸? | ||
| C. | 水、硝酸银溶液、稀硝酸 | D. | 水、氢氧化钾溶液、稀硝酸? |
15.“混盐”是指一种金属离子与多种酸根离子构成的盐,氯化硝酸钙[Ca(NO3)Cl]就是一种混盐.“复盐”是指含有两种或者两种以上金属阳离子和一种酸根离子构成的盐如KA1(SO4)2•12H2O.下列化合物中属于混盐的是( )
| A. | CaOCl2 | B. | (NH4)2Fe(SO4)2 | C. | Na3A1F6 | D. | Cu2(OH)2CO3 |
16.已知:
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O;
②Cl2+2FeCl2═2FeCl3;
③2KI+2FeCl3═2KCl+I2+2FeCl2.
则下列判断正确的是( )
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O;
②Cl2+2FeCl2═2FeCl3;
③2KI+2FeCl3═2KCl+I2+2FeCl2.
则下列判断正确的是( )
| A. | 氧化性:MnO4-<Cl2<Fe3+<I2 | |
| B. | 还原性:Fe2+>I->Cl- | |
| C. | FeCl3能使湿润的淀粉碘化钾试纸变蓝 | |
| D. | 反应①中只体现盐酸的还原性 |
 工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则
工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则