题目内容
10.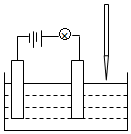 在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 醋酸中逐滴加入氢氧化钠溶液 | B. | 硫酸钠中逐滴加入氢氧化钡溶液 | ||
| C. | 硫酸中逐滴加入氢氧化钡溶液 | D. | 盐酸中逐滴加入硝酸银溶液 |
分析 电解质溶液导电性与离子浓度成正比,与所带电荷成正比,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮,说明加入另一种溶液时,离子浓度先减小后增大,据此分析解答.
解答 解:A.醋酸中逐滴加入氢氧化钠溶液过程中,离子浓度先增大,当二者完全反应后继续加入NaOH溶液,离子浓度变化不大,所以看到的现象是灯泡变亮,故A不选;
B.硫酸钠中逐滴滴入氢氧化钡溶液,二者反应生成硫酸钡和NaOH,离子浓度变化不大,灯泡亮度变化不大,故B不选;
C.硫酸溶液中滴入氢氧化钡溶液,二者反应生成硫酸钡沉淀和水,离子浓度减小灯泡变暗,当二者恰好完全反应时,离子浓度很小,灯泡不亮,继续加入氢氧化钡溶液,离子浓度增大,灯泡变亮,故C选;
D.盐酸溶液中滴入硝酸银溶液,二者反应生成AgCl和硝酸,离子浓度变化不大,则灯泡亮度变化不大,故D不选;
故选C.
点评 本题以电解质溶液导电性强弱为载体考查离子反应,明确发生的反应及溶液中存在的离子及其浓度是解本题关键,侧重考查学生分析判断能力,题目难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
20.部分短周期元素的原子结构及相关性质如表所示:
(1)T在元素周期表中的位置为第三周期第ⅥA族.
(2)X的一种同位素可用于测定文物年代,该同位素为614C (用原子符号表示).
(3)Z单质的电子式为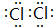 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列能证明这一事实的是d(填字母)
a.常温下,Z单质为气体,T单质为固体 b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高 d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生反应的化学方程式为HCl+NH3=NH4Cl,产物中含有的化学键类型为离子键、共价键.
| 元素编号 | 元素性质或原子结构 |
| T | 最高正价与最低负价的代数和为4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 最高正价是+7价 |
(2)X的一种同位素可用于测定文物年代,该同位素为614C (用原子符号表示).
(3)Z单质的电子式为
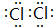 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列能证明这一事实的是d(填字母)
a.常温下,Z单质为气体,T单质为固体 b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高 d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生反应的化学方程式为HCl+NH3=NH4Cl,产物中含有的化学键类型为离子键、共价键.
5.误服重金属盐使人中毒,应及时采用哪种措施救助?( )
| A. | 喝大量冷开水 | B. | 喝大量食盐水 | ||
| C. | 喝大量牛奶 | D. | 注射大量葡萄糖水 |
15.“混盐”是指一种金属离子与多种酸根离子构成的盐,氯化硝酸钙[Ca(NO3)Cl]就是一种混盐.“复盐”是指含有两种或者两种以上金属阳离子和一种酸根离子构成的盐如KA1(SO4)2•12H2O.下列化合物中属于混盐的是( )
| A. | CaOCl2 | B. | (NH4)2Fe(SO4)2 | C. | Na3A1F6 | D. | Cu2(OH)2CO3 |
2.下列分子的价电子模型(VSEPR模型)和分子的模型相同的是( )
| A. | CO2 | B. | NH3 | C. | H2O | D. | SO2 |
20.对于化学反应能否自发进行,下列说法中错误的是( )
| A. | 若△H<0,△S>0,任何温度下都能自发进行 | |
| B. | 若△H>0,△S<0,任何温度下都不能自发进行 | |
| C. | 需要加热才能够进行的过程肯定不是自发过程 | |
| D. | 非自发过程在一定条件下可能变成自发过程 |