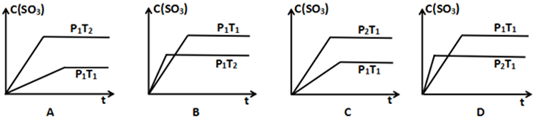
题目内容
12.100mL 6mol/L的硫酸跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的( ) ①硫酸钠固体,②醋酸钠固体,③硫酸钾溶液,④硝酸钾溶液.| A. | ①② | B. | ③④ | C. | ②③ | D. | ②③④ |
分析 过量的锌粉反应,硫酸完全反应,为了减缓反应速率但又不影响生成氢气的总量,可减小氢离子浓度但不改变其物质的量,以此来解答.
解答 解:①硫酸钠固体不反应,浓度不变,则速率不变,故不选;
②醋酸钠固体,减小氢离子浓度但不改变其物质的量,反应速率减小,生成氢气的量不变,故选;
③加硫酸钾溶液,不反应,由于体积变大,减小氢离子浓度但不改变其物质的量,反应速率减小,生成氢气的量不变,故选;
④加入硝酸钾,酸性条件下硝酸根离子具有强氧化性,与锌反应不生成氢气,故不选;
故选C.
点评 本题考查影响化学反应速率的因素,为高频考点,注意信息中Zn过量及浓度对反应速率的影响即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
2.一定温度下,可逆反应A2(s)+3B2(g)?2AB3(g)达到平衡的标志是( )
| A. | 容器内每减少1mol A2,同时生成2mol AB3 | |
| B. | 容器内每减少1mol A2,同时消耗3mol B2 | |
| C. | 容器内每减少1mol A2,同时消耗1mol B2 | |
| D. | 容器内每减少1mol A2,同时生成3mol B2 |
3.下列各组物质按化合物、单质和混合物顺序排列的是( )
| A. | 烧碱、氧气、碘酒 | B. | 小苏打、石灰水、二氧化硫 | ||
| C. | 干冰、铁、氯化氢 | D. | 空气、氮气、胆矾 |
7.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA | |
| D. | 通常状况下,NA 个CO2分子占有的体积为22.4L |
17.在不引入新杂质的情况下,分离FeCl3、KCl、BaSO4的混合物,应选用的一组试剂是( )
| A. | 水、氢氧化钾溶液、稀盐酸 | B. | 水、氢氧化钠溶液、稀盐酸? | ||
| C. | 水、硝酸银溶液、稀硝酸 | D. | 水、氢氧化钾溶液、稀硝酸? |
20.部分短周期元素的原子结构及相关性质如表所示:
(1)T在元素周期表中的位置为第三周期第ⅥA族.
(2)X的一种同位素可用于测定文物年代,该同位素为614C (用原子符号表示).
(3)Z单质的电子式为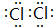 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列能证明这一事实的是d(填字母)
a.常温下,Z单质为气体,T单质为固体 b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高 d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生反应的化学方程式为HCl+NH3=NH4Cl,产物中含有的化学键类型为离子键、共价键.
| 元素编号 | 元素性质或原子结构 |
| T | 最高正价与最低负价的代数和为4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 最高正价是+7价 |
(2)X的一种同位素可用于测定文物年代,该同位素为614C (用原子符号表示).
(3)Z单质的电子式为
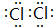 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列能证明这一事实的是d(填字母)
a.常温下,Z单质为气体,T单质为固体 b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高 d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生反应的化学方程式为HCl+NH3=NH4Cl,产物中含有的化学键类型为离子键、共价键.