题目内容
9.如图所示的装置,将电路接通后,向(乙)中滴人酚酞溶液,在Fe极附近显红色.试回答下列问题: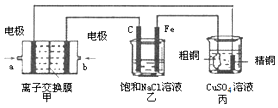
(1)(甲)装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,则b处通入的是O2(填“CH4”或“O2”),a处电极上发生的电极反应式是CH4+10OH--8e-=CO32-+7H2O;
(2)在(乙)装置中,石墨(C)电极上发生氧化(填“氧化”或“还原”) 反应;(乙)装置中总反应的离子方程式是:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑.
(3)如果(丙)装置中精铜电极的质量增加了6.4g,则(甲)装置中消耗的 CH4的质量为0.4g,(乙)装置中,铁电极上产生的气体在标准状况下为2.24L.
分析 (1)电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连,则在Fe极附近显红色,所以Fe是阴极,据此确定其他电极名称;
(2)C为阳极,阳极上氯离子失电子生成氯气;电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠溶液;
(3)乙装置中精铜电极的质量增加了6.4g,根据电极反应:Cu2++2e-=Cu,即生成6.4g即0.1mol铜,转移电子是0.2mol,根据电子守恒计算消耗的甲烷和生成的氢气.
解答 解:电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连,则在Fe极附近显红色,所以Fe是阴极,C为阳极,a是负极、b是正极,粗铜是阳极,精铜是阴极
(1)(甲)装置是甲烷燃料电池(电解质溶液为KOH溶液),a是负极、b是正极,则b处通入的是氧气,a极通入的是甲烷,a处电极上发生的电极反应式为CH4+10OH--8e-=CO32-+7H2O;
故答案为:O2;CH4+10OH--8e-=CO32-+7H2O;
(2)C为阳极,阳极上氯离子失电子生成氯气,发生氧化反应;电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠溶液,电极离子方程式为:;
故答案为:氧化;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑;
(3)乙装置中精铜电极的质量增加了6.4g,根据电极反应:Cu2++2e-=Cu,即生成6.4g即0.1mol铜,转移电子是0.2mol,铁电极是阴极,该极上产生氢气,2H++2e-=H2↑,当转移0.2mol电子时,该极上产生的气体为0.1mol,在标准状况下体积为2.24L,甲烷失去电子,电极反应为CH4-8e-+10OH-=CO32-+7H2O,消耗的 CH4的物质的量为$\frac{0.2mol}{8}$=0.025mol,质量为0.025mol×16g/mol=0.4g;
故答案为:0.4g;2.24L.
点评 本题考查原电池和电解原理,明确电池反应中元素的化合价变化、发生的反应是解答的关键,注意放电顺序的应用及电子守恒,题目难度中等,侧重于考查学生的分析能力和计算能力.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| 实验序号 | H2C2O4溶液 | KMnO4溶液 | 温度 |
| Ⅰ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅱ | 20mL 0.1mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅲ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 50℃ |
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该反应过程中发生的实验现象溶液紫色变浅(或溶液紫色褪去),有无色气泡产生.
(2)实验Ⅰ、Ⅲ(填实验序号)探究的是温度对化学反应速率的影响.
(3)若用如图一进行该实验.
①在实验过程中装药品前必须进行的实验操作检查装置气密性(填操作名称).若反应相同时间,则针筒中所得CO2的体积由大到小的顺序是Ⅲ>Ⅰ>Ⅱ(填实验序号).
②若实验Ⅰ在2min末收集了4.48mL CO2(气体体积已换算为标准状况下),则在2min末,c(MnO4-)=0.0052mol•L-1.
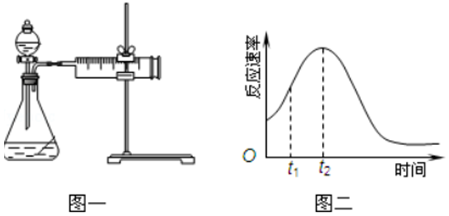
(4)该实验小组同学发现KMnO4和H2C2O4(草酸)反应的反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热;②产物Mn2+(或MnSO4)是反应的催化剂.
| 序号 | 金属质量 g | 金属状态 | c(H2SO4) mol•L-1 | V(H2SO4) mL | 溶液温度/℃ | 金属消失的 时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
(2)仅表明反应物浓度对反应速率产生影响的实验有1、3、4、6、8或2、5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.
| A. | NO | B. | CO | C. | 甲醛 | D. | SO2 |
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5k1•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中总反应的热化学方程式为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ•mol-1.
830℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0(填“>”、“<”或“=”).
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L、c(H2)=2.4mol/L,5min后达到平衡、CO的转化率为50%,则5min内CO的平均反应速率为0.1mol/(L•min).
(3)反应②2CH3OH(g)═CH3OCH3(g)+H2O(g) 在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.64 | 0.50 | 0.50 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol•L-1.
(4)“二甲醚燃料电池”是一种绿色电源,其中工作原理如图所示.
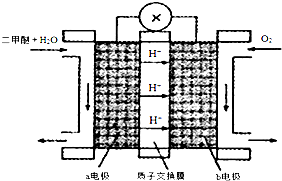
①该电池a电极上发生的电极反应式CH3OCH3+3H2O-12e-=2CO2+12H+.
②如果用该电池作为电解装置,当有23g二甲醚发生反应时,则理论上提供的电量表达式为0.5mol×12×1.6×10-19C×6.02×1023
mol-1C (1个电子的电量为1.6×10-19C).
