题目内容
14.将氯化铁溶液蒸干,再灼烧得到的固体物质是( )| A. | FeCl3 | B. | Fe2O3 | C. | Fe(OH)3 | D. | Fe3O4 |
分析 FeCl3溶液在加热时水解生成Fe(OH)3,Fe(OH)3灼烧分解生成Fe2O3,以此解答该题.
解答 解:在FeCl3溶液中,Fe3+发生水解生成Fe(OH)3:FeCl3+3H2O?Fe(OH)3+3HCl,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3,又由于灼热使Fe(OH)3分解生成Fe2O3.2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,
故选B.
点评 本题考查盐类水解的应用,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握水解的原理及应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.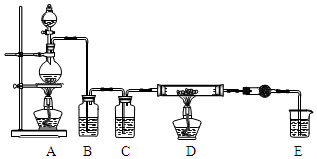 无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
探究一 无水AlCl3的实验室制备
利用如图装置,用干燥、纯净的氯气在加热条件下与铝粉(已除去氧化膜)反应制取无水AlCl3.供选择的药品:①铝粉 ②浓硫酸 ③稀盐酸 ④饱和食盐水 ⑤二氧化锰粉末 ⑥无水氯化钙 ⑦稀硫酸 ⑧浓盐酸 ⑨氢氧化钠溶液
(1)写出装置A烧瓶中发生的反应方程式MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)实验开始前,先检查装置气密性,后装入药品,接下来的步骤依次是bca(填序号)
a.加热D中硬质玻璃管 b.往A烧瓶中加入液体 c.点燃A中的酒精灯
(3)写出无水AlCl3与水蒸气反应的化学方程式AlCl3+3H2O(g)=Al(OH)3+3HCl.
探究二 无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如表:
(4)根据表中数据,计算所得固体中无水AlCl3的质量分数86.5%.
(5)有同学认为测得的无水AlCl3的质量分数偏低,你认为可能的原因有①②③:(填序号)
①制备的氯气不足,②固体和气体无法充分接触,③无水AlCl3发生升华,造成损失.
 无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.探究一 无水AlCl3的实验室制备
利用如图装置,用干燥、纯净的氯气在加热条件下与铝粉(已除去氧化膜)反应制取无水AlCl3.供选择的药品:①铝粉 ②浓硫酸 ③稀盐酸 ④饱和食盐水 ⑤二氧化锰粉末 ⑥无水氯化钙 ⑦稀硫酸 ⑧浓盐酸 ⑨氢氧化钠溶液
(1)写出装置A烧瓶中发生的反应方程式MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)实验开始前,先检查装置气密性,后装入药品,接下来的步骤依次是bca(填序号)
a.加热D中硬质玻璃管 b.往A烧瓶中加入液体 c.点燃A中的酒精灯
(3)写出无水AlCl3与水蒸气反应的化学方程式AlCl3+3H2O(g)=Al(OH)3+3HCl.
探究二 无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如表:
| 第一次实验 | 第二次实验 | 第三次实验 | |
| D中固体用量 | 2.0g | 2.0g | 2.0g |
| 氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
(5)有同学认为测得的无水AlCl3的质量分数偏低,你认为可能的原因有①②③:(填序号)
①制备的氯气不足,②固体和气体无法充分接触,③无水AlCl3发生升华,造成损失.
2.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
9.已知25℃时同浓度的NaClO、NaCN、NaHCO3、CH3COONa四种溶液pH一次减小,则下列四种酸中酸性最强的是( )
| A. | CH3COOH | B. | H2CO3 | C. | HCN | D. | HClO |
19.一实验小组用酸性KMnO4和H2C2O4(草酸,水溶液为无色的二元弱酸)反应研究影响反应速率的因素,其欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
(1)完成KMnO4和H2C2O4(草酸)反应的离子反应方程式:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该反应过程中发生的实验现象溶液紫色变浅(或溶液紫色褪去),有无色气泡产生.
(2)实验Ⅰ、Ⅲ(填实验序号)探究的是温度对化学反应速率的影响.
(3)若用如图一进行该实验.
①在实验过程中装药品前必须进行的实验操作检查装置气密性(填操作名称).若反应相同时间,则针筒中所得CO2的体积由大到小的顺序是Ⅲ>Ⅰ>Ⅱ(填实验序号).
②若实验Ⅰ在2min末收集了4.48mL CO2(气体体积已换算为标准状况下),则在2min末,c(MnO4-)=0.0052mol•L-1.

(4)该实验小组同学发现KMnO4和H2C2O4(草酸)反应的反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热;②产物Mn2+(或MnSO4)是反应的催化剂.
| 实验序号 | H2C2O4溶液 | KMnO4溶液 | 温度 |
| Ⅰ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅱ | 20mL 0.1mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅲ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 50℃ |
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该反应过程中发生的实验现象溶液紫色变浅(或溶液紫色褪去),有无色气泡产生.
(2)实验Ⅰ、Ⅲ(填实验序号)探究的是温度对化学反应速率的影响.
(3)若用如图一进行该实验.
①在实验过程中装药品前必须进行的实验操作检查装置气密性(填操作名称).若反应相同时间,则针筒中所得CO2的体积由大到小的顺序是Ⅲ>Ⅰ>Ⅱ(填实验序号).
②若实验Ⅰ在2min末收集了4.48mL CO2(气体体积已换算为标准状况下),则在2min末,c(MnO4-)=0.0052mol•L-1.

(4)该实验小组同学发现KMnO4和H2C2O4(草酸)反应的反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热;②产物Mn2+(或MnSO4)是反应的催化剂.
3.在一个绝热的容积固定的密闭容器中发生可逆反应:mA(g)+nB(g)?pC(g)+qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是:①体系的压强不再改变,②体系的温度不再改变,③各组分的浓度不再改变,④各组分的质量分数不再改变,⑤反应速率,v(A):v(B):v(C):v(D)=m:n:p:q,⑥单位时间内m mol A中化学键断裂的同时有p mol C中化学键也断裂.下列组合完全正确的是( )
| A. | ①③④⑤ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | ②③④⑤ |
4.表是稀硫酸与某金属反应的实验数据:
(1)实验4和5表明,固体反应物的表面积对反应速率有影响;
(2)仅表明反应物浓度对反应速率产生影响的实验有1、3、4、6、8或2、5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.
| 序号 | 金属质量 g | 金属状态 | c(H2SO4) mol•L-1 | V(H2SO4) mL | 溶液温度/℃ | 金属消失的 时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
(2)仅表明反应物浓度对反应速率产生影响的实验有1、3、4、6、8或2、5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.

 N2O4(g)已达平衡状态,因反应是放热反应,放置时气体温度下降,平衡向正反应方向移动,NO2浓度降低.[已知2NO2(g)?N2O4(g)在几微秒内即可达到化学平衡].
N2O4(g)已达平衡状态,因反应是放热反应,放置时气体温度下降,平衡向正反应方向移动,NO2浓度降低.[已知2NO2(g)?N2O4(g)在几微秒内即可达到化学平衡].