题目内容
10. 对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:
对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:(1)T0对应的V正与V逆关系是V正=V逆(填“>”、“<”、“=”).
(2)A、B两点正反应速率的大小关系VA<VB(填“>”、“<”、“=”).
(3)温度T<T0时,Wc逐渐增大的原因是反应还没有到达平衡,反应向正反应进行,随着温度升高,生成的C越来越多
(4)500℃条件下,该反应 K=2.33,测得某时刻,A(g)、B(g)、C(g)的浓度均为0.5mol/L,则此时v(正)> v(逆)(填“>”“<”或“=”)
分析 (1)由图可知,温度T0前,C的质量分数增大,故未达平衡,反应向正反应进行,温度T0后,C的质量分数减小,平衡向逆反应进行,故温度T0时,反应到达平衡状态;
(2)A、B两点,各组分的浓度相同,温度越高反应速率越快;
(3)反应还没有到达平衡,反应正向进行,随着温度升高,生成的C越来越多;
(4)根据平衡时各物质的浓度幂之积,与平衡常数相比较比较可得到正逆反应速率的大小关系.
解答 解:(1)由图可知,温度T0前,C的质量分数增大,故未达平衡,反应向正反应进行,温度T0后,C的质量分数减小,平衡向逆反应进行,故温度T0时,反应到达平衡状态,故V正=V逆,
故答案为:=;
(2)A、B两点,各组分的浓度相同,温度越高反应速率越快,故VA<VB,
故答案为:<;
(3)温度T0前,反应还没有到达平衡,反应向正反应进行,随着温度升高,生成的C越来越多,
故答案为:反应还没有到达平衡,反应向正反应进行,随着温度升高,生成的C越来越多;
(4)测得某时刻,A(g)、B(g)、C(g)的浓度均为0.5mol/L,则$\frac{0.{5}^{2}}{0.5×0.5}$=1<2.33,则平衡正向移动,正反应速率大于逆反应速率.
故答案为:>.
点评 本题考查化学平衡图象、影响化学平衡的因素等,为高频考点,难度中等,关键根据C的质量分数判断温度T0前未达平衡,从T0后为平衡状态.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.利用1L 3mol•L-1的盐酸、1L 3mol•L-1的氢氧化钠溶液和足量的铝单质,最多可以制备得到氢氧化铝的物质的量为( )
| A. | 1mol | B. | 3mol | C. | 4mol | D. | 6mol |
1.据统计,2015年入冬以来,华北黄淮地区己经出现4次严重雾霾过程,持续时间达37天.氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法.
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.发生的化学反应是2NH3(g)+NO(g)+NO2(g)═2N2(g)+3H2O(g)△H<0.
①当该反应有l mol N2(g)生成时,电子转移总数是3NA或1.806×1023.
②为了加快反应反应速率,并且提高的转化率,采取的措施是a(填字母).
a.增大NH3的浓度 b.增大N2的浓度 c.增大压强 d.选择合适的催化剂
(2)消除氮氧化物的另一种方法是用甲烷催化还原氮氧化物,己知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol
②N2(g)+2O2(g)=2NO2(g)△H=-67.0kJ/mol
①则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-823.3kJ/mol
②在3.0L密闭容器中,通入0.10mol CH4和0.20mol NO2,在一定温度进行反应,反应时间表(t)与容器内气体总压强(p)的数据如表:
该温度下的平衡常数K=0.0675.
(3)利用ClO2消除氮氧化物的污染,反应过程如下:(部分反应物或生成物略去)
N2$→_{反应I}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na_{2}SO_{3}溶液}$NO
反应I的产物中还有两种强酸生成,且其中一种强酸硝酸与NO2的物质的量相等,若有11.2L N2生成(标准状况),共消耗ClO267.5g.
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.发生的化学反应是2NH3(g)+NO(g)+NO2(g)═2N2(g)+3H2O(g)△H<0.
①当该反应有l mol N2(g)生成时,电子转移总数是3NA或1.806×1023.
②为了加快反应反应速率,并且提高的转化率,采取的措施是a(填字母).
a.增大NH3的浓度 b.增大N2的浓度 c.增大压强 d.选择合适的催化剂
(2)消除氮氧化物的另一种方法是用甲烷催化还原氮氧化物,己知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol
②N2(g)+2O2(g)=2NO2(g)△H=-67.0kJ/mol
①则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-823.3kJ/mol
②在3.0L密闭容器中,通入0.10mol CH4和0.20mol NO2,在一定温度进行反应,反应时间表(t)与容器内气体总压强(p)的数据如表:
| 时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
(3)利用ClO2消除氮氧化物的污染,反应过程如下:(部分反应物或生成物略去)
N2$→_{反应I}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na_{2}SO_{3}溶液}$NO
反应I的产物中还有两种强酸生成,且其中一种强酸硝酸与NO2的物质的量相等,若有11.2L N2生成(标准状况),共消耗ClO267.5g.
18.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 钢铁制品的腐蚀常以析氢腐蚀为主 | |
| B. | 厨房中常用碳酸钠溶液洗涤餐具上的油污 | |
| C. | 明矾[KAl(SO4)2•12H2O]用于水的杀菌消毒 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 |
5.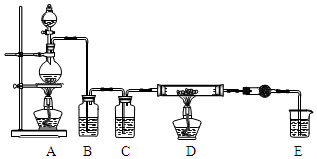 无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
探究一 无水AlCl3的实验室制备
利用如图装置,用干燥、纯净的氯气在加热条件下与铝粉(已除去氧化膜)反应制取无水AlCl3.供选择的药品:①铝粉 ②浓硫酸 ③稀盐酸 ④饱和食盐水 ⑤二氧化锰粉末 ⑥无水氯化钙 ⑦稀硫酸 ⑧浓盐酸 ⑨氢氧化钠溶液
(1)写出装置A烧瓶中发生的反应方程式MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)实验开始前,先检查装置气密性,后装入药品,接下来的步骤依次是bca(填序号)
a.加热D中硬质玻璃管 b.往A烧瓶中加入液体 c.点燃A中的酒精灯
(3)写出无水AlCl3与水蒸气反应的化学方程式AlCl3+3H2O(g)=Al(OH)3+3HCl.
探究二 无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如表:
(4)根据表中数据,计算所得固体中无水AlCl3的质量分数86.5%.
(5)有同学认为测得的无水AlCl3的质量分数偏低,你认为可能的原因有①②③:(填序号)
①制备的氯气不足,②固体和气体无法充分接触,③无水AlCl3发生升华,造成损失.
 无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.探究一 无水AlCl3的实验室制备
利用如图装置,用干燥、纯净的氯气在加热条件下与铝粉(已除去氧化膜)反应制取无水AlCl3.供选择的药品:①铝粉 ②浓硫酸 ③稀盐酸 ④饱和食盐水 ⑤二氧化锰粉末 ⑥无水氯化钙 ⑦稀硫酸 ⑧浓盐酸 ⑨氢氧化钠溶液
(1)写出装置A烧瓶中发生的反应方程式MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)实验开始前,先检查装置气密性,后装入药品,接下来的步骤依次是bca(填序号)
a.加热D中硬质玻璃管 b.往A烧瓶中加入液体 c.点燃A中的酒精灯
(3)写出无水AlCl3与水蒸气反应的化学方程式AlCl3+3H2O(g)=Al(OH)3+3HCl.
探究二 无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如表:
| 第一次实验 | 第二次实验 | 第三次实验 | |
| D中固体用量 | 2.0g | 2.0g | 2.0g |
| 氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
(5)有同学认为测得的无水AlCl3的质量分数偏低,你认为可能的原因有①②③:(填序号)
①制备的氯气不足,②固体和气体无法充分接触,③无水AlCl3发生升华,造成损失.
15.下列物质属于同分异构体的是( )
| A. | 麦芽糖和蔗糖 | B. | 蛋白质和氨基酸 | C. | 油和脂 | D. | 淀粉和纤维素 |
2.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
19.一实验小组用酸性KMnO4和H2C2O4(草酸,水溶液为无色的二元弱酸)反应研究影响反应速率的因素,其欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
(1)完成KMnO4和H2C2O4(草酸)反应的离子反应方程式:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该反应过程中发生的实验现象溶液紫色变浅(或溶液紫色褪去),有无色气泡产生.
(2)实验Ⅰ、Ⅲ(填实验序号)探究的是温度对化学反应速率的影响.
(3)若用如图一进行该实验.
①在实验过程中装药品前必须进行的实验操作检查装置气密性(填操作名称).若反应相同时间,则针筒中所得CO2的体积由大到小的顺序是Ⅲ>Ⅰ>Ⅱ(填实验序号).
②若实验Ⅰ在2min末收集了4.48mL CO2(气体体积已换算为标准状况下),则在2min末,c(MnO4-)=0.0052mol•L-1.
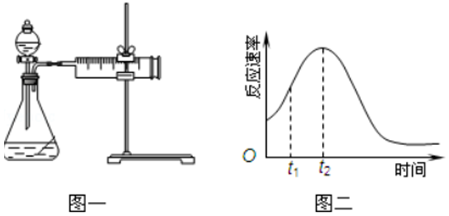
(4)该实验小组同学发现KMnO4和H2C2O4(草酸)反应的反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热;②产物Mn2+(或MnSO4)是反应的催化剂.
| 实验序号 | H2C2O4溶液 | KMnO4溶液 | 温度 |
| Ⅰ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅱ | 20mL 0.1mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅲ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 50℃ |
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该反应过程中发生的实验现象溶液紫色变浅(或溶液紫色褪去),有无色气泡产生.
(2)实验Ⅰ、Ⅲ(填实验序号)探究的是温度对化学反应速率的影响.
(3)若用如图一进行该实验.
①在实验过程中装药品前必须进行的实验操作检查装置气密性(填操作名称).若反应相同时间,则针筒中所得CO2的体积由大到小的顺序是Ⅲ>Ⅰ>Ⅱ(填实验序号).
②若实验Ⅰ在2min末收集了4.48mL CO2(气体体积已换算为标准状况下),则在2min末,c(MnO4-)=0.0052mol•L-1.

(4)该实验小组同学发现KMnO4和H2C2O4(草酸)反应的反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热;②产物Mn2+(或MnSO4)是反应的催化剂.